
����Ŀ���Է�ú�ң���Ҫ�ɷ֣�Al2O3��SiO2������Fe2O3��Ϊԭ�ϣ���ȡAl2O3�IJ��ֹ����������£�

���������գ�
(1)��ԭ�Ӻ�����_____�ֲ�ͬ�����ĵ��ӣ��������ӵĹ��ʽ��_____________�����������漰�ڶ�����Ԫ�ص�ԭ�Ӱ뾶��С�����˳����______________________________��
(2) ���������ǽ�Fe3+ת��ΪFe(OH)3��������Ӧ�����ӷ���ʽΪ______________________��������Һ��Fe3+�Ƿ�����ķ�����____________________________________________��
(3)���͡��ᾧ����������AlCl3Ũ��Һ��ͨ��HCl�����ԭ��______________________
(4)�������̿�ѭ����������_______________��
(5)��ҵ�Ͻ�Al2O3�ܽ����ۻ��ı���ʯ�е���������÷�Ӧ�Ļ�ѧ����ʽΪ___________��
���𰸡�5 ![]() O<N<C Fe3++3HCO3��=Fe(OH)3��+3CO2�� ���ã�ȡ�ϲ���Һ���Թ��У�����KSCN��Һ����Һ�����ɫ�����ѳ�����Ԫ�أ�����Ѫ��ɫ����δ���� AlCl3Ũ��Һ�д��ڽᾧƽ�⣺AlCl3��6H2O��s��
O<N<C Fe3++3HCO3��=Fe(OH)3��+3CO2�� ���ã�ȡ�ϲ���Һ���Թ��У�����KSCN��Һ����Һ�����ɫ�����ѳ�����Ԫ�أ�����Ѫ��ɫ����δ���� AlCl3Ũ��Һ�д��ڽᾧƽ�⣺AlCl3��6H2O��s�� ![]() Al3++3Cl-+6 H2O ͨ��HCl���壬����Cl-Ũ�ȣ�ʹƽ�����ƣ��ܵõ������AlCl3��6H2O���� HCl 2Al2O3(����)
Al3++3Cl-+6 H2O ͨ��HCl���壬����Cl-Ũ�ȣ�ʹƽ�����ƣ��ܵõ������AlCl3��6H2O���� HCl 2Al2O3(����)![]() 4Al+3O2��
4Al+3O2��
��������
������ͼ��֪�����ú���м���Ũ���ᣬ���������������������������Ȼ������Ȼ������������費�ܽ⣬���˵õ������Ȼ������Ȼ�������Һ������Һ�м���̼�������Һ�����Ȼ���ת��Ϊ��������������ȥ�����˵õ������Ȼ�����Һ����Һ���Ȼ�����Һ���Ȼ�������������Ũ������ȴ�ᾧ�õ���ˮ�Ȼ�����������ˮ�Ȼ����Ƶ���������
��1����Ԫ�ص�ԭ������Ϊ13��������13�����ӣ���������Ų�ʽΪ1s22s22p63s23p1������ԭ�Ӻ�����1s��2s��2p��3s��3p��5�ֲ�ͬ�����ĵ��ӣ��������ӵĹ��ʽ��![]() ���������漰���ĵڶ�����Ԫ��ΪC��N��O��ͬ����Ԫ�أ�������ԭ�Ӱ뾶���μ�С�����Ӱ뾶��С�����˳����O<N<C���ʴ�Ϊ��5��
���������漰���ĵڶ�����Ԫ��ΪC��N��O��ͬ����Ԫ�أ�������ԭ�Ӱ뾶���μ�С�����Ӱ뾶��С�����˳����O<N<C���ʴ�Ϊ��5��![]() ��O<N<C��
��O<N<C��
(2)���������Ĺ�����������������̼��������ӷ���˫ˮ�ⷴӦ�����������������Ͷ�����̼���壬��Ӧ�����ӷ���ʽΪFe3++3HCO3��=Fe(OH)3��+3CO2��������Һ��Fe3+����������Һ�е���KSCN��Һ����Һ������ɫ���ʴ�Ϊ��Fe3++3HCO3��=Fe(OH)3��+3CO2�������ã�ȡ�ϲ���Һ���Թ��У�����KSCN��Һ����Һ�����ɫ�����ѳ�����Ԫ�أ�����Ѫ��ɫ����δ������
��3��AlCl3Ũ��Һ�д����ܽ�ƽ�⣺AlCl3��6H2O��S�� ![]() Al3+��aq��+3Cl-��aq��+6 H2O��l������AlCl3Ũ��Һ��ͨ��HCl���壬������Һ��Cl-Ũ�ȣ�ʹƽ�����淴Ӧ�����ƣ�������AlCl3��6H2O�����������ʴ�Ϊ��AlCl3Ũ��Һ�д��ڽᾧƽ�⣺AlCl3��6H2O��S��
Al3+��aq��+3Cl-��aq��+6 H2O��l������AlCl3Ũ��Һ��ͨ��HCl���壬������Һ��Cl-Ũ�ȣ�ʹƽ�����淴Ӧ�����ƣ�������AlCl3��6H2O�����������ʴ�Ϊ��AlCl3Ũ��Һ�д��ڽᾧƽ�⣺AlCl3��6H2O��S�� ![]() Al3++3Cl-+6 H2O��ͨ��HCl���壬����Cl-Ũ�ȣ�ʹƽ�����ƣ��ܵõ������AlCl3��6H2O���壻
Al3++3Cl-+6 H2O��ͨ��HCl���壬����Cl-Ũ�ȣ�ʹƽ�����ƣ��ܵõ������AlCl3��6H2O���壻
��4���Ȼ�����Һ���Ȼ�������������Ũ������ȴ�ᾧ�õ���ˮ�Ȼ����Ĺ����������Ȼ��⣬������ˮ�Ȼ����Ƶ���������ͬʱ���Ȼ������ɣ������̿�ѭ�����������Ȼ��⣬�ʴ�Ϊ��HCl��
(5)��ҵ�Ͻ�Al2O3�ܽ����ۻ��ı���ʯ�е����������������Ӧ�Ļ�ѧ����ʽΪ2Al2O3(����)![]() 4Al+3O2�����ʴ�Ϊ��2Al2O3(����)
4Al+3O2�����ʴ�Ϊ��2Al2O3(����)![]() 4Al+3O2����
4Al+3O2����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾΪʵ���ҳ���װ�á��ش��������⣺
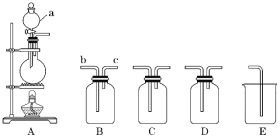
��1������a������Ϊ____��
��2�����ö���������Ũ���ᷴӦ�Ʊ����ռ�Cl2ʱ����������װ�� A��B��C��D��E�������ʵ��� �Լ���װ��B�б���ʳ��ˮ��������____������װ��C����Cl2��ѡ�õ��Լ���____��װ��E��������____��
��3������ͭ��ϡ���ᷴӦ�Ʊ����ռ�NOʱ������װ��A��B��E�������� �����Լ���A�з�Ӧ�����ӷ���ʽΪ____��A�е�����Ӧ����B��___(����b������c��)�ˡ�ʵ������й۲쵽A�г����˺���ɫ�����ռ�������Ϊ��ɫ��ԭ����____(�û�ѧ����ʽ��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I��N��Li��Na�γɵ�Li3N��NaN3�Ȼ����������Ҫ����;�����������գ�
(1)��ԭ�Ӻ���������ߵĵ��������Ĺ���ǣ�____________������Ӻ�����ӵĹ����ʾʽ�ǣ�____________��
(2)��֪Li3N�۵�Ϊ845�棬NH3�۵㩁77.7�棬�����ʽṹ��֪ʶ˵�������ֺ����������۵����Ŀ���ԭ��____________��
II���о��߷����������ѭ���ϳɰ��Ĺ��գ����������£�
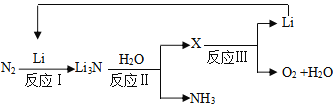
(3)ÿ�ϳ�1mol����ת�Ƶ���____________mol���ù������յõ�������������____________��
(4)д����Ӧ��Ļ�ѧ��Ӧ����ʽ��____________����0.35gLi3N�м���40mL1mol/L�����ᣬ������Һ������Ũ���ɴ�С��˳���ǣ�____________��
(5)��Ԫ���������ܵõ�____________������ţ���
A�����ԣ�LiOH��NaOH B����ˮ��Ӧ�ľ��ҳ̶ȣ�Li��Na
C���ܽ�ȣ�LiOH��NaOH D���ܶȣ�Li��Na
(6)NaN3������������ȫ���ң���ײʱ�������·�Ӧ����NaN3+��KNO3����K2O+��Na2O+��N2������ƽ�˷�Ӧ�Ļ�ѧ����ʽ�����������ת�Ƶ���Ŀ�ͷ���____________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС������NaI��Һ��ͨ������Cl2�õ������Һ�������ú����Һ��ȡNaI���壬ʵ���������£�

��֪��Ӧ����2I��+2Cu2++![]() +H2O
+H2O![]() 2CuI��+
2CuI��+![]() +2H+��
+2H+��
�ش��������⣺
��1������ʵ������Ҫ�IJ�����������ͨ©�����ձ���_____________��
��2����Ӧ����CuI����������ԭ����ֻ��NO2���÷�Ӧ�Ļ�ѧ����ʽΪ_________________������95.5 g CuI���뷴Ӧ������Ҫ�����______________L��O2���ܽ����ɵ�NO2��ˮ����ȫת��Ϊ���ᡣ
��3��������B�к�����Ԫ�أ���ԭ������һ��Ԫ��ԭ�ӵ����ʵ���֮��Ϊ3��8������B�Ļ�ѧʽΪ_____________��
��4����Ӧ�������ɺ�ɫ�������ɫ���壬��ɫ������׳�Ϊ��������������Ӧ���Ļ�ѧ����ʽΪ______��
��5����������Cl2ͨ�뺬12 g NaI����Һ�У�һ��ʱ������Һ���ɵõ����������Ϊ_________g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��������A�е�Ũ����μӵ�ʢ��MnO2����ƿ�У����Ⱥ��������������ͨ��װ��B��C��Ȼ����ͨ�����ȵ�ʯӢ������D�����������ۣ�����ش�
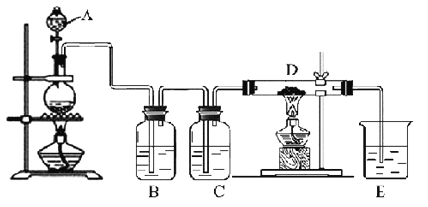
��1������A��������________����ƿ�з�Ӧ�Ļ�ѧ����ʽ��_____________________��
��2��װ��B��ʢ��Һ����___������ͨ��װ��B��Ŀ����__________________��װ��C��ʢ�ŵ�Һ����_________��
��3��D�з�Ӧ�Ļ�ѧ����ʽ��__________________________________________��
��4���ձ�E��ʢ�ŵ�Һ����_____����Ӧ�����ӷ���ʽ��___________��
��5�����ϱ���D�в������������ʣ�����������������ȴ��������������H2O��g�����ҷ�Ӧ��Ϊ�ռ�D�в����D��E֮�䣬�������ռ�װ���⣬����Ҫ����__װ�á�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�ĸ������ʾһ�ַ�Ӧ���������(ijЩ�����Ѿ���ȥ)�����г�����A��C��DΪ��ɫ���壬C��ʹʪ��ĺ�ɫʯ����ֽ������
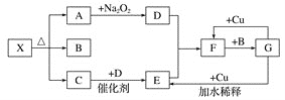
��1��д������X�Ļ�ѧʽ��__��
��2��д�����б仯�Ļ�ѧ����ʽ��
��A��D��___��
��G��E��___��
��F��G��___��
��3��ʵ��������ü��ȹ�������ķ�����ȡ����C����д����ѧ����ʽ��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������и���Һ�У���������һ���ܴ����������
A.ʹ��̪��Һ������Һ��Na����Cl����SO42����Fe3��
B.С�մ���Һ��K����SO42����Cl����H��
C.������Ӧ����H2����Һ�У�Na����K����CO32����Cl��
D.�����£�ǿ������Һ�У�Na����Fe3����NO3����SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڸ����£�Fe��ˮ�����ɷ�����Ӧ��Ӧ������װ�ã��Ϳ�����ɴ˷�Ӧ��ʵ�顣

��1������A������Ϊ____________����ײ����˼�Ƭ���Ƭ����������____________��
��2��ʵ��ǰ���������װ�ý��еIJ�����_________________��ʵ�鿪ʼʱӦ�ȵ�ȼ_____����ƾ��ơ��ƾ���ơ�����
��3������Ӧ���ɵĹ�����д��ԣ�д������ˮ������Ӧ�Ļ�ѧ����ʽ__________________��
��4����д����D���ռ�β���ķ�����___________________________�����Ҫ��D����ȼβ���������Ը��������____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������A��B��C��D�������壬A���ܶ���С�����壬B��ͨ������³ʻ���ɫ������������ֱ�ͨ��������������Һ�У�ͨ��B��D����ʱ���������ְ�ɫ������������A������B�а�����ȼ�գ�������ɫ�Ļ��沢����D������ɫ�̼���ζ����Cͨ�����ʯ��ˮʱ����ǡ�
��1��A��B��C��D �ķ���ʽ�ֱ�Ϊ��
A_______________ B_______________C_______________D_______________
��2��д�����и���Ӧ�Ļ�ѧ����ʽ��
A��B______________________________________________
B��ˮ____________________________________________
C�����ʯ��ˮ______________________________________
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com