
【题目】二氧化氯(ClO2)是高效安全的饮用水消毒剂,得到越来越广泛的应用.回答下列问题:
(1)实验室合成ClO2常用盐酸或双氧水还原氯酸钠(NaClO3).
①盐酸和NaClO3反应时有ClO2和Cl2生成,反应的离子方程式为 , 当反应中转移0.2mol 电子时,参加反应的还原剂的物质的量为 .
②使用双氧水作还原剂的优点是 .
(2)ClO2可用于合成亚氯酸钠(NaClO2).将ClO2通入NaOH溶液中,并加入适量双氧水,在稳定装置中充分反应可制得NaClO2成品. 已知:当pH≤2.0时,NaClO2能被I﹣完全还原成Cl﹣;二氧化氯(ClO2)是高效安全的饮用水消毒剂,得到越来越广泛的应用.回答下列问题:
溶液中Na2S2O3能与I2反应生成NaI和Na2S4O6 . 欲测定成品中NaClO2的含量,现进行如下操作:
步骤Ⅰ | 称取样品Wg配成溶液置于锥形瓶中,并调节PH≤2.0 |
步骤Ⅱ | 向锥形瓶中加入足量KI晶体,充分搅拌,并加入少量指示剂 |
步骤Ⅲ | 用c mol/L的Na2S2O3溶液滴定 |
①步骤2发生反应的离子方程式为 , 加入指示剂的名称是 .
②若上述滴定操作中平均消耗VmL Na2S2O3标准溶液,则成品中NaClO2的质量分数为(用含w、c、V的代数式表示).
(3)ClO2和Cl2均能将电镀废水中的CN﹣氧化为无毒的物质,自身被还原为Cl﹣ . 处理含相同量CN﹣的电镀废水,所需Cl2的物质的量是ClO2的倍.
【答案】
(1)2ClO3﹣+4H++2Cl﹣=2ClO2↑+Cl2↑+2H2O;0.2mol;使用双氧水作还原剂时氧化产物为氧气,对环境无污染
(2)ClO2﹣+4H++4I﹣=2I2+Cl﹣+2H2O,滴入最后一滴标准溶液,溶液由蓝色变化为无色且半分钟不变化;淀粉溶液;![]() ×100%
×100%
(3)2.5
【解析】解:(1)①盐酸和NaClO3反应时有ClO2和Cl2生成,反应的离子方程式为 2ClO3﹣+4H++2Cl﹣=2ClO2↑+Cl2↑+2H2O,反应中HCl为还原剂,被氧化生成氯气,化合价由﹣1价升高到0价,当转移0.2mol电子时,参加反应的还原剂的物质的量为为0.2mol,所以答案是:2ClO3﹣+4H++2Cl﹣=2ClO2↑+Cl2↑+2H2O;0.2mol.②双氧水作还原剂时氧化产物为氧气,对环境无污染,
所以答案是:使用双氧水作还原剂时氧化产物为氧气,对环境无污染;(2)①步骤Ⅱ中发生反应是酸性溶液中ClO2﹣能被I﹣完全还原成Cl﹣ , 碘离子被氧化为碘单质,离子方程式为:ClO2﹣+4H++4I﹣=2I2+Cl﹣+2H2O,溶液中Na2S2O3能与I2反应:2Na2S2O3+I2=2NaI+Na2S4O6 , 可以用淀粉溶液作指示剂,
所以答案是:ClO2﹣+4H++4I﹣=2I2+Cl﹣+2H2O,淀粉溶液;②依据ClO2﹣+4H++4I﹣=2I2+Cl﹣+2H2O,2Na2S2O3+I2=2NaI+Na2S4O6 , 反应的定量关系计算得到,设NaClO2 ,
ClO2﹣ | ~ | 2I2 | ~ | 4Na2S2O3 |
1 | 4 | |||
x | cV×10﹣3mol |
x= ![]() ,
,
样品中NaClO2的质量分数= ![]() ×100%=
×100%= ![]() ×100%,
×100%,
所以答案是: ![]() ×100%.(3)每摩尔Cl2得到2mol电子,而每摩尔ClO2得到5mol电子,则所需Cl2的物质的量是ClO2的:
×100%.(3)每摩尔Cl2得到2mol电子,而每摩尔ClO2得到5mol电子,则所需Cl2的物质的量是ClO2的: ![]() =2.5倍,
=2.5倍,
所以答案是:2.5.


科目:高中化学 来源: 题型:
【题目】2019年9月25日,全世界几大空之一―—北京大兴国际机场,正式投运。下列相关说法不正确的是( )
A.机杨航站楼所用钢铁属于合金材料
B.航站楼使用的玻璃是无机非金属材料
C.航站楼采用的隔震支座由橡胶和钢板相互叠加粘结而成,属于新型无机材料
D.机场高速应用自融冰雪路面技术,减少了常规融雪剂使用对环境和桥梁结构造成的破坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )。
A.患口腔溃疡时我们可服用维生素B2 , 它存在于牛奶和蛋黄等食物中
B.多吃胡萝卜可预防夜盲症,因其中含有丰富的维生素A
C.维生素C具有止血功能,所以被称为抗坏血酸
D.维生素K是凝血酶元的主要成分,它是止血的功臣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素C又名抗坏血酸,具有酸性和强还原性,也是一种常见的食品添加剂,其结构如图.下列有关说法中正确的是( ) 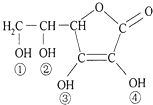
A.维生素C与足量金属钠反应产生氢气是维生素C物质的量的4倍
B.维生素C因为含有酯基而难溶于水
C.维生素C中含有醚键
D.维生素C的酸性可能是③、④两个羟基引起的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氧化镍(NiOOH)可用作镍氢电池的正极材料.以含镍(Ni2+)废液为原料生产NiOOH的一种工艺流程如图1: 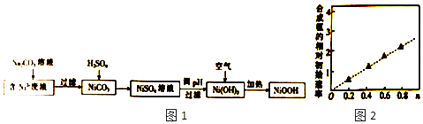
(1)加入Na2CO3溶液时,证明Ni2+已经完全沉淀的实验方法是 . 过滤时需用到的玻璃仪器有烧杯、
(2)写出碳酸镍与稀硫酸反应的离子方理式 .
(3)硫酸镍溶液可用于制备合成氨的催化剂ConNi(1﹣n)Fe2O4 . 在其他条件相同时合成氨的相对初始速率随催化剂中n值变化的曲线如图,由图分析可知Co2+、Ni2+两种离子中催化效果更好的是
(4)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式: .
(5)若加热不充分,则制得的NiOOH中会混有Ni(OH)2 , 其组成可表示为xNiOOHy Ni(OH)2 . 现称取9.21g样品溶于稀硫酸中,冷却后转入容量瓶并配制成500mL溶液.取出25.00mL,用0.100mol/LKMnO4标准溶液滴定,用去KMnO4标准溶液10.00mL,则x:y= . [已知反应(未配平):Ni2++MnO4﹣+H+→Ni2++Mn2++H2O].
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实.2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g),则可推测该反应是吸热反应
B.室温下,将浓度为0.1mol?L ̄1HF溶液加水稀释,其电离平衡常数和 ![]() 均不变
均不变
C.电解精练铜时,阳极泥中常含有金属金、银、锌等
D.锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后再用酸溶解去除
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 含有离子键的化合物一定是离子化合物
B. 在共价化合物中一定含有共价键
C. 只含有共价键的物质一定是共价化合物
D. 双原子单质分子中的共价健一定是非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程不属于化学变化的是( )
A.在蛋白质溶液中,加入饱和硫酸铵溶液,有沉淀析出
B.皮肤不慎沾上浓硝酸而呈现黄色
C.在蛋白质溶液中,加入硫酸铜溶液,有沉淀析出
D.用稀释的福尔马林溶液(0.1%~0.5%)浸泡植物种子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com