(2011?静安区模拟)某化工厂联合生产纯碱、镁、阻燃剂.以白云石(CaCO
3?MgCO
3)为原料冶炼镁:经高温煅烧生成的氧化物在还原炉中经1200℃用硅铁还原生成镁蒸汽(铁化合价不变),镁蒸汽经冷凝为粗镁;同时以海水为原料制碱和制阻燃剂.具体流程如下:
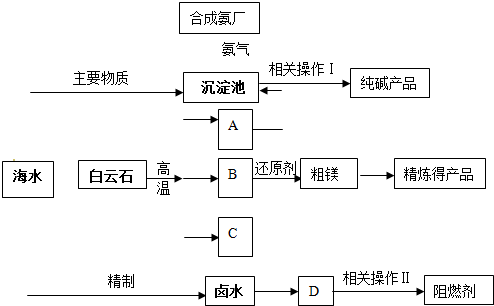
(1)分别写出A、B、C的化学式
CO2
CO2
、
MgO
MgO
、
CaO
CaO
;沉淀池中反应的化学方程式是
CO2+NH3+NaCl+H2O→NaHCO3↓+NH4Cl
CO2+NH3+NaCl+H2O→NaHCO3↓+NH4Cl
.
(2)硅铁还原生成镁蒸汽时选择低压和1200℃,试分析选择这种反应条件的原因
低压有利于镁蒸气的生成及分离;1200℃只有镁为气体,从速率和平衡2个角度都有利于镁的生成
低压有利于镁蒸气的生成及分离;1200℃只有镁为气体,从速率和平衡2个角度都有利于镁的生成
.
(3)精制卤水中的MgCl
2与适量石灰乳反应生成碱式氯化镁[Mg(OH)Cl]沉淀,此时溶液中主要溶质是(写化学式)
CaCl2
CaCl2
.
(4)描述流程中相关操作Ⅰ包括过滤、
洗涤
洗涤
、
煅烧(或加热)
煅烧(或加热)
.
(5)已知:Mg(OH)
2(s)→MgO(s)+H
2O(g)-81.5kJ;
Al(OH)
3(s)→0.5Al
2O
3(s)+1.5H
2O(g)-87.7kJ
①Mg(OH)
2能起阻燃作用,其原因是
Mg(OH)2受热分解时吸收大量的热使环境温度下降;同时生成的耐高温、稳定性好的MgO、覆盖在可燃物表面,产生阻燃作用
Mg(OH)2受热分解时吸收大量的热使环境温度下降;同时生成的耐高温、稳定性好的MgO、覆盖在可燃物表面,产生阻燃作用
.
②等质量Mg(OH)
2和Al(OH)
3相比,阻燃效果较好的是
Mg(OH)2
Mg(OH)2
.
(6)某化工厂利用上图所示流程联合生产纯碱、镁、阻燃剂,试分析该生产的优点
原料易得价廉、原料利用率高、中间产物能有效地循环利用、产品结构的多样化
原料易得价廉、原料利用率高、中间产物能有效地循环利用、产品结构的多样化
.



 同步轻松练习系列答案
同步轻松练习系列答案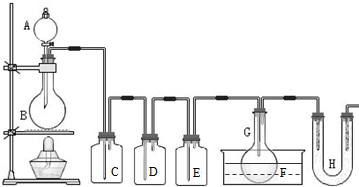 (2011?静安区模拟)用如图所示装置制取PCl3,在E中放入足量白磷,将氯气不间断地通入E,氯气与白磷就会发生反应,并放出热量(温度高于75℃).已知:PCl3和 PCl5遇水强烈反应,它们熔沸点数据如下:
(2011?静安区模拟)用如图所示装置制取PCl3,在E中放入足量白磷,将氯气不间断地通入E,氯气与白磷就会发生反应,并放出热量(温度高于75℃).已知:PCl3和 PCl5遇水强烈反应,它们熔沸点数据如下: