
| V(酸) |
| V(碱) |
| 10b-14 |
| 10-a |
| V(酸) |
| V(碱) |
| 1 |
| 100 |


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
| A、IA族元素与ⅦA族元素间形成的化合物一定含离子键 |
| B、第二周期元素从左到右,最高正价从+1递增到+7,最低负价从-4升高到-1 |
| C、同主族非金属元素的简单阴离子还原性越强,其气态氢化物的稳定性越弱 |
| D、同周期主族金属元素的化合价越高,其原子失电子能力越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 糖尿病是由于体内胰岛素紊乱导致的代谢紊乱综合症,以高血糖为主要标志.长期摄入高热量食品和缺少运动都易导致糖尿病.
糖尿病是由于体内胰岛素紊乱导致的代谢紊乱综合症,以高血糖为主要标志.长期摄入高热量食品和缺少运动都易导致糖尿病.查看答案和解析>>
科目:高中化学 来源: 题型:
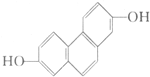 质子核磁共振谱是研究有机化合物结构的有力手段之一.结构中的等效氢原子核磁共振谱中都给出了相应的峰值 (信号),谱中峰的强度与结构中的H原子数成正比.试回答,结构简式为如图所示的有机化合物:
质子核磁共振谱是研究有机化合物结构的有力手段之一.结构中的等效氢原子核磁共振谱中都给出了相应的峰值 (信号),谱中峰的强度与结构中的H原子数成正比.试回答,结构简式为如图所示的有机化合物:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


| KMnO4/H+ |
 (-R1、-R2表示氢原子或烃基);
(-R1、-R2表示氢原子或烃基);
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3溶液中:c(H+)+c(Na+)=c(OH-)+c(CO32-)+c(HCO3-) |
| B、0.1mol?L-1的NH4Cl溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
| C、向NH4HSO4的水溶液中逐滴滴入NaOH溶液,至中性的溶液中:c(Na+)>c(SO42-)>c(NH4+)>c(H+)=c(OH-) |
| D、pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后的溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 用酸性氢氧燃料电池为电源电解CuSO4溶液,实验装置如图所示.下列关于此装置的说法中,正确的是( )
用酸性氢氧燃料电池为电源电解CuSO4溶液,实验装置如图所示.下列关于此装置的说法中,正确的是( )| A、燃料电池工作时,负极反应为O2+4H++4e-═2H2O |
| B、a极是石墨,b极是铜时,b极的电极反应为:4OH--4e-═2H2O+O2↑ |
| C、a极是石墨,b极是纯铜时,电解一定时间后两极产生的气体体积都为224ml(标准状况),则原溶液的浓度是0.1mol/L |
| D、a、b两极均是石墨时,若a极产生的气体为56mL(标准状况),则U形管中溶液的PH为2(体积变化忽略不计) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com