
分析 (1)根据分子的构型来解答;
(2)根据杂化轨道数判断杂化类型,杂化轨道数=δ键数+孤对电子对数,据此判断杂质类型;
(3)根据分子的空间构型分析;
(4)同种元素之间形成非极性共价键,不同元素之间形成极性共价键,分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,这样的分子为极性分子;正负电荷的重心重合,电荷分布均匀,则为非极性分子.
解答 解:(1)①CH4是正四面体结构;②CH≡CH是直线形分子;③NH4+是正四面体结构;④BF3是平面三角形分子;⑤H2O是V形分子;
故答案为:①③;
(2)①CH4中C原子杂化轨道数=δ键数+孤对电子对数=4+0=4,所以采取sp3杂化,
②C2H2中C原子杂化轨道数=δ键数+孤对电子对数=2+0=2,所以采取sp杂化,
③NH4+中氮原子杂化轨道数=δ键数+孤对电子对数=4+0=4,所以采取sp3杂化,
④BF3中B原子杂化轨道数=δ键数+孤对电子对数=3+0=3,所以采取sp2杂化;
⑤H2O中O原子杂化轨道数=δ键数+孤对电子对数=2+2=4,所以采取sp3杂化;
所以采取sp3杂化的化合物是①③⑤;为sp2杂化的是④;为sp杂化的是②;
故答案为:①③⑤;④;②;
(3)②C2H2是直线形分子,所有原子共平面也共线;
④BF3是平面三角形分子,所有原子共平面而不共线;
⑤H2O是V形分子,所有原子共平面而不共线;
故答案为:②④⑤;②;
(4)①CH4分子中含有碳氢极性键,正负电荷的重心重合,电荷分布均匀,为非极性分子;
②C2H2分子中含有碳氢极性键,碳碳非极性键,正负电荷的重心重合,电荷分布均匀,为非极性分子;
③NH4+不是分子;
④BF3分子中含有硼氢极性键,正负电荷的重心重合,电荷分布均匀,为非极性分子;
⑤H2O分子中含有氢氧极性键,电荷的分布是不均匀的,不对称,为极性分子;
所以含有极性键的极性分子是⑤;
故答案为:⑤.
点评 本题主要考查了原子的杂化、分子的空间构型、原子共面、分子的极性等知识,注意对应知识的掌握,题目难度中等,注意把握分子杂化类型的判断方法.


科目:高中化学 来源: 题型:选择题
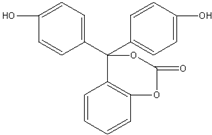
| A. | 该有机物的化学式为C20H14O5 | |
| B. | 该有机物分子中的三个苯环不可能共平面 | |
| C. | 该有机物可发生加成、取代、氧化、消去等反应 | |
| D. | 1mol该有机物与足量NaOH 溶液充分反应,消耗NaOH的物质的量为5 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
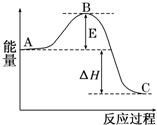 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1molSO3(g)的△H=-99kJ/mol.
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1molSO3(g)的△H=-99kJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1S22S22p63S23p64S14p5 | B. | 1S22S22p63S23d54S1 | ||
| C. | 1S22S22p63S23p63d6 | D. | 1S22S22p63S23p64S23d4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构式为:CH2CH2 | |
| B. | NH4C1的电子式: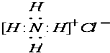 | |
| C. | Cr原子 的基态简化电子排布式为[Ar]3d54s1 | |
| D. | S原子的价电子轨道表示式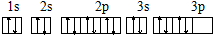 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 0.1 mol•L-1的氨水中含有的NH3•H2O分子数为0.1 NA | |
| B. | 0.1 mol•L-1 Na2CO3溶液中所含的Na+离子数为0.2 NA | |
| C. | 标准状况下,2.24 L的水含有的分子数为0.1NA | |
| D. | 一定条件下,3.2 g O2和O3混合气体中含有的O原子数目为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 元素Q与W形成的两种常见化合物中含有相同比例的阴、阳离子,与水反应产物不完全相同 | |
| B. | 元素T、Q、W、Y的原子半径大小为:T<Q<Y<W | |
| C. | Q与Y组成的常见物质是一种两性物质,结构中含有离子键 | |
| D. | 由Y和T组成的物质YT是,在电子和陶瓷工业上有广泛应用,可以直接由单质Y和T在低温下合成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com