
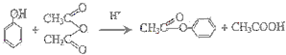
 ,G的结构简式
,G的结构简式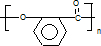 .
. .
. .
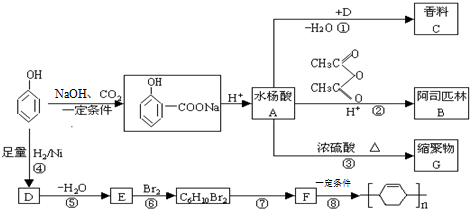
.分析 苯酚与足量氢气发生加成反应环己醇,则D为 ,
, 发生消去反应生成E,E为
发生消去反应生成E,E为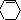 ,与溴发生加成反应生成C6H10Br2,C6H10Br2发生消去反应生成F,F为
,与溴发生加成反应生成C6H10Br2,C6H10Br2发生消去反应生成F,F为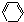 ,
,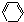 发生加聚反应生成
发生加聚反应生成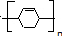 ,水杨酸为
,水杨酸为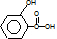 ,
, 与
与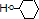 发生酯化反应生成C,C为
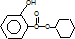
发生酯化反应生成C,C为 ,由题给信息可知B为
,由题给信息可知B为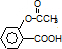 ,水杨酸发生缩聚反应生成G,则G为
,水杨酸发生缩聚反应生成G,则G为 ,结合有机物的结构和性质解答该题.
,结合有机物的结构和性质解答该题.
解答 解:苯酚与足量氢气发生加成反应环己醇,则D为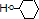 ,
,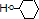 发生消去反应生成E,E为
发生消去反应生成E,E为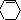 ,与溴发生加成反应生成C6H10Br2,C6H10Br2发生消去反应生成F,F为
,与溴发生加成反应生成C6H10Br2,C6H10Br2发生消去反应生成F,F为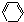 ,
,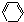 发生加聚反应生成
发生加聚反应生成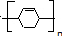 ,水杨酸为
,水杨酸为 ,
, 与
与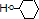 发生酯化反应生成C,C为
发生酯化反应生成C,C为 ,由题给信息可知B为
,由题给信息可知B为 ,水杨酸发生缩聚反应生成G,则G为
,水杨酸发生缩聚反应生成G,则G为 ,
,
(1)④发生加成反应,⑦发生消去反应,
故答案为:加成反应;消去反应;
(2)通过以上分析知,C的结构简式为 ,G的结构简式为
,G的结构简式为 ,
,
故答案为: ;
; ;
;
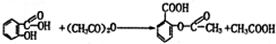
(3)反应②为水杨酸和乙酸酐发生酯化反应,方程式为 ,
,
故答案为: ;
;
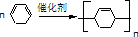
(4)反应⑧为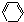 的加聚反应,方程式为
的加聚反应,方程式为 ,
,
故答案为: ;
;
(5) 中含有酚羟基,可与氯化铁反应生成紫色物质,
中含有酚羟基,可与氯化铁反应生成紫色物质,
故答案为:a.
点评 本题考查有机物的推断,题目难度中等,解答该题的关键是把握题给信息,注意根据物质的结构判断可能具有的性质.


科目:高中化学 来源: 题型:解答题
| 序号 | 实 验 步 骤 | 现 象 | 探究目的和结论 |
| ③ | 将刚削皮的苹果立刻放入隔绝空气的环境中 | 相当长一段时间内,无明显变化 | 探究目的:探究空气中的O2对苹果“褐变”的影响 结论:“褐变”是苹果中的某些物质与空气中的O2发生反应,生成有色物质.(或没有空气O2的参与,苹果不发生“褐变” |
| ④ | 将刚削皮的苹果立刻放入90℃~95℃的水中2min,再放在空气中. 再将另一块刚削皮的苹果立刻放入稀盐酸中浸泡2min后取出洗净,再放在空气中.将盐酸改为酒精、醋酸铅溶液进行相同实验. | 相当长一段时间内,均无明显变化 | 探究目的:探究氧化酶对苹果“褐变”的影响 结论:经加热或稀盐酸浸泡,酶变性而失去催化能力,没有氧化酶的催化,苹果不发生“褐变”.(或苹果发生“褐变”,必须在氧化酶的催化下才能发生. . |
| ⑤ | 在刚削皮的苹果上滴加FeCl3溶液. | 苹果由白色变为绿色 | 探究目的:探究苹果中是否含有酚类物质. 结论:苹果中含有酚类物质. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用试管取试剂瓶中的碳酸钠溶液时,发现取量过多,为了不浪费立即把多余的试剂倒入原试剂瓶中 | |
| B. | 硝酸钡溶于水,故可将含硝酸钡的废液倒入水槽,再用水冲入下水道 | |
| C. | 用蒸发的方法使氯化钠从溶液中析出,应将蒸发皿中的氯化钠溶液全部加热蒸干 | |
| D. | 稀释浓硫酸时,将浓硫酸缓缓注入水中,并不断搅拌 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
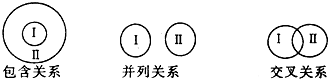
| A. | 电解质与非电解质属于包含关系 | |
| B. | 化合物与碱性氧化物属于包含关系 | |
| C. | 单质与化合物属于交叉关系 | |
| D. | 氧化还原反应与分解反应属于并列关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
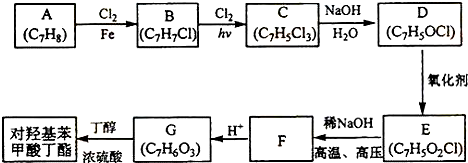
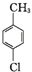 +2Cl2$\stackrel{hv}{→}$
+2Cl2$\stackrel{hv}{→}$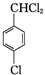 +2HCl,该反应过程中涉及的反应类型是取代反应.
+2HCl,该反应过程中涉及的反应类型是取代反应.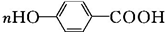 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$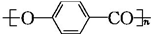 +nH2O.
+nH2O. ,D与银氨溶液发生反应的化学方程式为
,D与银氨溶液发生反应的化学方程式为 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$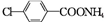 +H2O+2Ag↓+3NH3.
+H2O+2Ag↓+3NH3.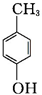 为原料制备G(
为原料制备G(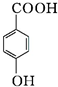 )的合成路线:
)的合成路线: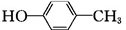 $\stackrel{CH_{3}I}{→}$
$\stackrel{CH_{3}I}{→}$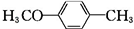 $\stackrel{KMnO_{4}}{→}$
$\stackrel{KMnO_{4}}{→}$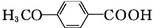 $\stackrel{HI}{→}$
$\stackrel{HI}{→}$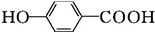 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,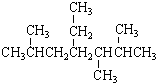 的名称为2,5,6-三甲基-4-乙基庚烷 的名称为2,5,6-三甲基-4-乙基庚烷 | |
| B. | 分子式为C7H16的有机物中有三种不同化学环境的氢原子,此有机物一定是2,4-二甲基戊烷 | |
| C. | 完全燃烧等质量的甲醛、乙酸、葡萄糖、蔗糖消耗的氧气量相等 | |
| D. | 一定条件下,完全燃烧14g含氧质量分数为a的乙烯、乙醛混合气体,则生成水的质量为18(1-a)g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用碳酸氢钠治疗胃酸过多 | |
| B. | 用双氧水给伤口清洗和消毒 | |
| C. | 用盐酸除去铁锈 | |
| D. | 用溶有碘化钾的淀粉试纸检验某装置是否漏出氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com