
(16分)某温度时,在2L容器中X、Y、Z三种气体物质的量随时间的变化关系曲线如图(2)所示。
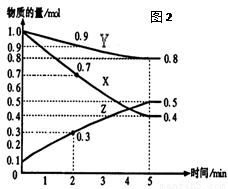
(1)由图中的数据分析,该反应的化学方程式为 。
(2)反应开始至5min,Z的平均反应速率为 ;
(3)反应开始至5min ,正反应速率逐渐 ;逆反应速率逐渐 , 5min后Z的物质的量不再改变,原因是下列的 ;
A.正逆反应都停止了
B.正反应速率为零
C.正逆反应速率相等,反应达到平衡状态
D.逆反应速率为零
(4)下列措施能使正反应速率增大的是
A.升高温度 B.降低温度
C.增大Y的浓度 D.减少Z的浓度
(1)3X+Y 2Z (3分)
(2)0.04 mol·(L·min)-1 (3分)
2Z (3分)
(2)0.04 mol·(L·min)-1 (3分)
(3)减小,增大,C。(每空2分) (4)AC(4分)
【解析】(1)根据图像可知反应进行到5min时,各种物质的物质的量不在发生变化,说明反应达到平衡状态,此时XYZ的物质的量的变化量分别是(mol)1.0-0.4=0.6、1.0-0.8=0.2、0.5-0.1=0.4,由于变化量之比是相应的化学计量数之比,所以方程式为X+Y 2Z。
2Z。
(2)反应速率通常用单位时间内浓度额变化量来表示,所以Z的反应速率是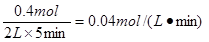 。
。
(3)由于随着反应的进行,反应物的浓度逐渐减小,生成物的浓度逐渐增大,所以正反应速率逐渐减小,逆反应速率逐渐增大。由于正逆反应速率相等(但不为0),所以反应达到平衡状态,即选项C是正确的,答案选C。
(4)考查外界条件对反应速率的影响,一般情况下,增大反应物的浓度、升高温度等可以使反应速率加快,所以答案选AC。


 能力评价系列答案
能力评价系列答案科目:高中化学 来源: 题型:
 G.
G. 

查看答案和解析>>
科目:高中化学 来源: 题型:
 某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示.
某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)某温度时,在2L容器中,X、Y、Z三种物质的物质的量随时间变化曲线如下图所示.由图中数据分析,该反应的化学方程式为:
(1)某温度时,在2L容器中,X、Y、Z三种物质的物质的量随时间变化曲线如下图所示.由图中数据分析,该反应的化学方程式为:查看答案和解析>>
科目:高中化学 来源: 题型:
 某温度时,在2L容器中X、Y、Z三种物质随时间的变化曲线如图所示,
某温度时,在2L容器中X、Y、Z三种物质随时间的变化曲线如图所示, 2Z
2Z 2Z
2Z查看答案和解析>>
科目:高中化学 来源: 题型:
 某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示.由图中数据分析:
某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示.由图中数据分析: 2Z
2Z 2Z
2Z查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com