
【题目】四氯化锡常作有机合成的催化剂。实验室用熔融的锡(熔点为231.9 ℃)与氯气反应制备SnCl4。装置如图所示(加热装置省略)。
已知:①SnCl4、SnCl2有关物理性质如表:
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 623 |
SnCl4 | 无色液体 | -33 | 114 |
②SnCl4在空气中极易水解生成SnO2·xH2O。
③在常温下,用KClO3和浓盐酸反应制备氯气。

(1)写出装置A中发生反应的化学方程式:_____。
(2)下列说法不正确的是____。(填字母)
A.F和C中试剂相同,E中的冰水冷却产品
B.导管L平衡气压,使浓盐酸顺利下滴
C.先通入氯气,当D充满黄绿色气体时加热烧瓶
D.除去产品中氯气的方法是加入SnCl2溶液
(3)用化学方程式表示拆去F装置对实验的影响:_____。
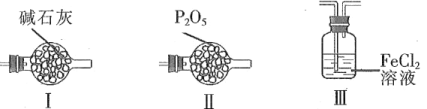
(4)F和G装置可以用下列装置代替的是____。(填代号)
(5)加热D使锡熔融后需要继续加热,其一为了加快锡与氯气反应,其二为了____。
(6)测定产品纯度。取ag产品溶于少量浓盐酸,加入蒸馏水稀释至250mL。取20mL稀释溶液于锥形瓶,滴加几滴淀粉溶液,用cmol·L-1I2溶液滴定至终点,消耗滴定溶液VmL。
①该产品中SnCl2含量为___%。(滴定反应:Sn2++I2=Sn4++2I-)
②若操作时间过长、振荡剧烈,测得产品中SnCl4含量___(填“偏高”“偏低”或“无影响”)。
【答案】KClO3+6HCl=KCl+3Cl2↑+3H2O D SnCl4+(2+x)H2O=SnO2·xH2O+4HCl↑ Ⅰ 使SnCl4气化 ![]() 偏高
偏高
【解析】
此题为综合性实验题,包含物质的制备、提纯、分离、收集、尾气处理,需要掌握常用的基本试验方法。还涉及了纯度计算和误差分析。
(1)氯酸钾与浓盐酸发生氧化还原反应反应生成氯化钾、氯气、水,方程式为KClO3+6HCl=KCl+3Cl2↑+3H2O。
(2)A.C中浓硫酸用于干燥氯气,F中浓硫酸吸收氢氧化钠溶液中挥发出来的水蒸气,A项正确;
B.导管L连通分液漏斗与烧瓶,确保浓盐酸在重力作用下顺利下滴,B项正确;
C.先通入氯气,排尽装置内空气,避免空气与锡反应,C项正确;
D.四氯化锡遇水剧烈反应,除去产品中氯气的方法是,加入锡,继续蒸馏,D项错误。
(3)四氯化锡遇水蒸气发生水解反应并放出氯化氢,方程式SnCl4+(2+x)H2O=SnO2·xH2O+4HCl↑。
(4)F、G装置用于吸收尾气中氯气,避免水蒸气与四氯化锡反应。Ⅰ装置中碱石灰用于吸收氯气、水蒸气,符合题意;Ⅱ装置不能吸收氯气,不符合题意;Ⅲ装置中水蒸气会进入E装置,不符合题意。
(5)依据四氯化锡的沸点、锡的熔点知,加热使锡熔化。继续加热使四氯化锡变成蒸气导入收集瓶中。
(6)![]() ,
,
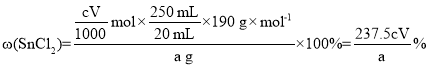 。
。
振荡剧烈、操作时间长,可能发生反应:4I-+O2+4H+=2I2+2H2O,2Sn2++O2+4H+=2Sn4++2H2O,结果氯化亚锡消耗I2量减小,测得氯化亚锡含量降低,而四氯化锡含量偏高。


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
【题目】以环戊烷为原料制备环戊二烯的合成路线如图,则下列说法正确的是( )
![]()
A. A的结构简式是![]()
B. ①②的反应类型分别是取代、消去
C. 反应②③的条件分别是浓硫酸加热、光照
D. 加入酸性KMnO4溶液,若溶液褪色则可证明![]() 已完全转化为
已完全转化为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:
![]()
![]()
制备苯乙酸的装置示意图如下(加热和夹持装置等略):

已知:苯乙酸的熔点为76.5 ℃,微溶于冷水,溶于乙醇。
(1)在250 mL三口瓶a中加入70 mL70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是_____________。
(2)将a中的溶液加热至100 ℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130 ℃继续反应。仪器c的名称及作用是______________。反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是______________。下列仪器中可用于分离苯乙酸粗品的是__________ (填编号)。
A.分液漏斗B.漏斗C.烧杯D.直形冷凝管E.玻璃棒
(3)提纯粗苯乙酸的方法是___________________。
(4)用CuCl22H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是_______________________。
(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中进行反应:![]() ,已知反应过程中某一时刻
,已知反应过程中某一时刻![]() 、
、![]() 、
、![]() 的浓度分别为
的浓度分别为![]() 、
、![]() 、
、![]() ,当反应达到平衡时,可能存在的数据是( )
,当反应达到平衡时,可能存在的数据是( )
A.![]() 为
为![]() 、
、![]() 为
为![]() B.
B.![]() 为
为![]()
C.![]() 为
为![]() 、
、![]() 为
为![]() D.
D.![]() 和
和![]() 均为
均为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中第三周期包括Na、Mg、Al、Si、P、S、Cl、Ar 8种元素。请回答下列问题:
(1)SCl2分子中的中心原子杂化轨道类型是_______,该分子构型为_________。
(2)第三周期8种元素按单质熔点(℃)大小顺序绘制的柱形图(已知柱形“1”代表Ar)如图所示,则其中“2”原子的结构示意图为____________,“8”原子的电子排布式为________________。

(3)氢化镁储氢材料的晶胞结构如图所示,已知该晶体的密度为ρ g·cm-3,则该晶体的化学式为__________,晶胞的体积为__________cm3(用ρ、NA表示,其中NA表示阿伏加德罗常数的值)。

(4)实验证明:KCl、MgO、CaO三种晶体的结构与NaCl晶体的结构相似,已知NaCl、KCl、CaO晶体的晶格能数据如下表:
晶体 | NaCl | KCl | CaO |
晶格能/(kJ·mol-1) | 786 | 715 | 3401 |
则KCl、MgO、CaO三种晶体的熔点从高到低的顺序是________________。其中MgO晶体中一个Mg2+周围和它最近且等距离的Mg2+有________个。
(5)噻吩(![]() )广泛应用于合成医药、农药、染料工业。
)广泛应用于合成医药、农药、染料工业。
①噻吩分子中含有_______个σ键,分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ),则噻吩分子中的大π键应表示为______________。
),则噻吩分子中的大π键应表示为______________。
②噻吩的沸点为84℃,吡咯(![]() )的沸点在129~131℃之间,后者沸点较高,其原因是__________________________________。
)的沸点在129~131℃之间,后者沸点较高,其原因是__________________________________。
(6)Si、C和O的成键情况如下:
化学键 | C—O | C===O | Si—O | Si===O |
360 | 803 | 464 | 640 |
C和O之间易形成含有双键的CO2分子晶体,而Si和O之间则易形成含有单键的SiO2原子晶体,请结合数据分析其原因:_______________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来甲醇用途日益广泛,工业上甲醇的合成途径多种多样。现有实验室中模拟甲醇合成反应,在2L密闭刚性的容器内,加入物质的量之比为![]() 的
的![]() 和
和![]() ,400℃时反应:
,400℃时反应:![]()
体系中![]() 随时间的变化如下表:
随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 5 |
| 0.020 | 0.011 | 0.008 | 0.007 | 0.007 |
(1)用![]() 表示从0~2s内该反应的平均速率
表示从0~2s内该反应的平均速率![]() _______________。
_______________。
(2)能说明该反应已达到平衡状态的是_______________。
a.![]() b.容器内压强保持不变
b.容器内压强保持不变
c.![]() d.容器内密度保持不变
d.容器内密度保持不变
(3)达到平衡时,甲醇在平衡体系中的体积分数为__________(保留小数点后一位)。
(4)![]() 与
与![]() 的反应可将化学能转化为电能,若用硫酸做电解质溶液形成原电池,
的反应可将化学能转化为电能,若用硫酸做电解质溶液形成原电池,![]() 应通入电池的_________极(“正”、“负”),且正极的电极反应式为_____________。
应通入电池的_________极(“正”、“负”),且正极的电极反应式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验过程中产生沉淀的物质的量(Y)与加入试剂的物质的量(X)之间的关系正确的是( )
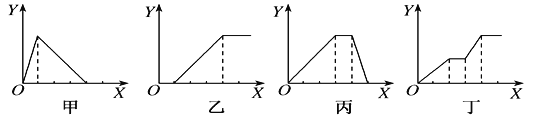
A. 甲向AlCl3溶液中逐滴加入NaOH溶液至过量且边滴边振荡
B. 乙向NaAlO2溶液中滴加稀盐酸至过量且边滴边振荡
C. 丙向NH4Al(SO4)2溶液中逐滴加入NaOH溶液直至过量
D. 丁向NaOH、Ba(OH)2、NaAlO2的混合溶液中逐渐通入CO2至过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】爱国实业家侯德榜在氨碱法的基础上,发明了“联合制碱法”,简单流程如图。完成下列问题:
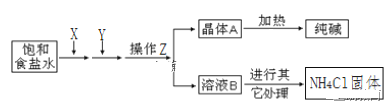
(1)在饱和食盐水中通入X和Y,则X____(填物质名称)
(2)写出通入X和Y的化学反应方程式_____。
(3)操作Z____(填名称),为了得到化肥(NH4Cl),需要在溶液B中通入NH3、加食盐,其中通入NH3的作用一____,作用二____。
(4)工业生产的纯碱常会含少量NaCl杂质。现用重量法测定其纯度,步骤如下:①称取样品ag,加水溶解;②加入足量的BaCl2溶液;③过滤、___、烘干、冷却、称量、烘干、冷却、___,最终得到固体bg。样品中纯碱的质量分数为____(用含a、b的代数式)
(5)某课外活动小组要用NaOH溶液和CO2来制备Na2CO3固体,他们只有未知浓度的NaOH溶液50毫升和足量的CO2,他们的设计方案是:首先_____,然后_____,加热_____后,再____,最后加热浓缩,冷却结晶,过滤得固体Na2CO3 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦炭催化还原二氧化硫的化学方程式为2C(s)+2SO2(g) ![]() S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如图所示,下列说法正确的是
S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如图所示,下列说法正确的是

A. 该反应的H>0B. C点时达到平衡状态
C. 增加C的量能够增大SO2的转化率D. T3时增大压强,能增大活化分子百分数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com