
分析 (1)电解饱和食盐水生成氯气、氢气和氢氧化钠;
(2)氯化铵溶液中氨根离子水解生成一水合氨和氯化氢;
(3)乙醇在负极发生氧化反应生成碳酸根离子和水.
解答 解:(1)电解饱和食盐水阳极上氯离子失电子发生氧化反应得到氯气,电解反应2Cl--2e-=Cl2↑,阴极上氢离子得到电子生成氢气,电解反应为2H++2e-=H2↑,总反应为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑,
故答案为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑;
(2)氯化铵溶液呈现酸碱性的离子方程式:NH4++H2O?NH3•H2O+H+,故答案为:NH4++H2O?NH3•H2O+H+;
(3)乙醇在负极发生氧化反应生成碳酸根离子和水,离子方程式为:C2H5OH+16OH--12e-=2CO32-+11H2O,故答案为:C2H5OH+16OH--12e-=2CO32-+11H2O.
点评 本题考查了离子方程式、化学方程式的书写,明确反应的实质是解题关键,注意原子个数守恒、电荷数守恒.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠用作呼吸面具中的供氧剂,每生成0.1molO2,转移电子的数目为0.4NA | |
| B. | 将1mL1mol/LFeCl3溶液逐滴加入沸水,制得红褐色Fe(OH)3胶体,所含胶粒的数目是1×10-3NA | |
| C. | 标准状况下,0.1molCl2溶于水,转移电子的数目为0.1NA | |
| D. | 7.8gNa2S和Na2O2的混合物中,含有的阴离子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫酸是工业生产中重要的产品之一,在很多领域都有重要用途.回答下列问题:
硫酸是工业生产中重要的产品之一,在很多领域都有重要用途.回答下列问题:| 压强 SO2转化率 温度 | 1.0×105Pa | 5.0×105Pa | 1.0×106Pa | 1.5×106Pa |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9989 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8528 | 0.8897 | 0.9276 | 0.9468 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验目的 | 实验操作 | 现象 | 结论 |
| 自来水中离子检验 | 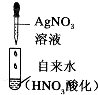 | 出现不溶于稀HNO3的沉淀 | 自来水中含氯离子 |
| 水的提纯 | 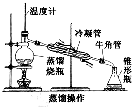 | 蒸馏烧瓶中水沸腾,冷凝管中有无色液体凝结,并通过冷凝管流入锥形瓶中 | 锥形瓶中收集到无色液体 |
| 蒸馏水中杂质离子的检验 | 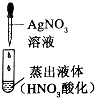 | 无明显现象 | 蒸馏水中不含氯离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 朝鲜第三次核试验产生的放射性物质的衰变为化学变化 | |
| B. | 燃烧化石燃料排放的废气中含大量CO2、SO2,形成酸雨 | |
| C. | 为防止垃圾污染城市,可采用露天焚烧或深埋的方法进行处理 | |
| D. | 用高纯度二氧化硅制作的光导纤维遇强碱会“断路” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤ | B. | ②③④⑤ | C. | ①③⑤⑥ | D. | ①②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
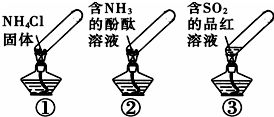 “封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是( )
“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是( )| A. | 加热时,①上部汇集了固体NH4Cl,说明NH4Cl的热稳定性比较好 | |
| B. | 加热时,②溶液褪色或红色变浅,冷却后又都变为红色 | |
| C. | 加热时,③溶液褪色或红色变浅,冷却后又都变为红色 | |
| D. | 三个“封管实验”中所发生的化学反应都是可逆反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应是放热反应,降低温度将缩短反应达到平衡的时间 | |
| B. | 其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 | |
| C. | 单位时间内消耗NO和N2的物质的量比为6:5时,反应达到平衡 | |
| D. | 平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com