
| 杂质 | 加入试剂 | 化学方程式 |
| 硫酸盐 | ||
| MgCl2 | ||
| CaCl2 |
分析 碳酸钠可除去钙离子,NaOH可除去镁离子,氯化钡可除去钡离子,但碳酸钠一定在氯化钡之后,则除去粗盐中含有的可溶性杂质CaCl2、MgCl2及Na2SO4,则所加试剂及其顺序是NaOH、BaCl2、Na2CO3,以此解答该题.
解答 解:碳酸钠可除去钙离子,NaOH可除去镁离子,氯化钡可除去钡离子,但碳酸钠一定在氯化钡之后,则除去粗盐中含有的可溶性杂质CaCl2、MgCl2及Na2SO4,则所加试剂及其顺序是NaOH、BaCl2、Na2CO3,涉及化学反应为Na2SO4+BaCl2=BaSO4↓+2NaCl,MgCl2+2NaOH=Mg(OH)2↓+2NaCl,CaCl2+Na2CO3=CaCO3↓+2NaCl,
故答案为:
| 杂质 | 加入试剂 | 化学方程式 |
| 硫酸盐 | BaCl2 | Na2SO4+BaCl2=BaSO4↓+2NaCl |
| MgCl2 | NaOH | MgCl2+2NaOH=Mg(OH)2↓+2NaCl |
| CaCl2 | Na2CO3 | CaCl2+Na2CO3=CaCO3↓+2NaCl |
点评 本题考查混合物分离、提纯方法的选择,为高频考点,把握离子的性质及除杂的试剂选择和顺序为解答的关键,侧重粗盐提纯的考查,题目难度不大.


科目:高中化学 来源: 题型:实验题
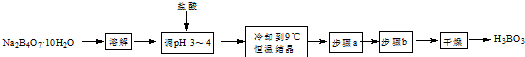
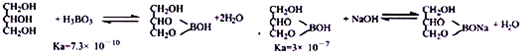
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
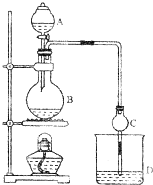 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、乙酸,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、乙酸,D中放有饱和碳酸钠溶液.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Tl+的最外层有1个电子 | B. | Tl3+的氧化性比Al3+强 | ||
| C. | Tl 能形成+3价和+1价的化合物 | D. | Tl+的还原性比Ag强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件未标出),其中反应①是置换反应,A是常见的金属单质,D是无色气体单质、F是黄绿色气态单质,反应①②均在水溶液中进行的.
A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件未标出),其中反应①是置换反应,A是常见的金属单质,D是无色气体单质、F是黄绿色气态单质,反应①②均在水溶液中进行的.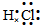 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ③④⑤ | C. | ②③⑤ | D. | ①③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com