
| A. | ①④ | B. | ①③ | C. | ②③ | D. | ②④ |
分析 Cu+4HNO3→Cu(NO2)2+2NO2↑+2H2O
①这是氧化还原反应;
②铜元素的化合价升高,失电子,反应中被氧化,而硝酸中氮的部分化合价降低,得电子被还原;
③浓硝酸生成二氧化氮;
④稀硝酸生成一氧化氮.
解答 解:①这是氧化还原反应,产物中不是单质和化合物非置换反应,故错误;
②铜元素的化合价升高,失电子,反应中被氧化,而硝酸中氮的部分化合价降低,得电子被还原,所以硝酸被还原,故正确;
③浓硝酸生成二氧化氮,所以硝酸是浓硝酸,而不是稀硝酸,故错误;
④稀硝酸生成一氧化氮,所用硝酸是浓硝酸,故正确;
故选:D.
点评 本题考查金属与硝酸反应,浓硝酸生成二氧化氮,稀硝酸生成一氧化氮,硝酸体现氧化性和酸性,比较容易!


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:选择题
| A. | S$→_{点燃}^{O_{2}}$SO2$\stackrel{BaCl(aq)}{→}$BaSO4 | |
| B. | SiO2 $\stackrel{H_{2}O}{→}$H2SiO3 $\stackrel{NaOH溶液}{→}$NaSiO3(aq) | |
| C. | MgCl2•6H2O$\stackrel{△}{→}$MgCl2$\stackrel{通电}{→}$Mg | |
| D. | 3mL5%NaOH溶液$\stackrel{3滴2%CuSO_{4}溶液}{→}$Cu(OH)2悬浊液$→_{△}^{葡萄糖}$Cu2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KNO3 | B. | MgSO4 | C. | CaCl2 | D. | NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
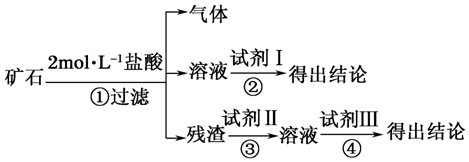
| 编号 | 实验操作 | 预期现象与结论 |
| ① | 取适量矿石研细,加足量2mol•L-1盐酸 | 有大量无色气体产生,得棕黄色溶液,且仍有少量固体残留 |
| ② | ||
| ③ | 取①操作残余固体适量置于烧杯,加入足量2mol•L-1NaOH溶液,充分搅拌 | 残余固体完全溶解于2mol•L-1NaOH溶液,并得无色溶液 |
| ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 14g由N2和13C2H2组成的混合物所含的电子数为7NA | |
| B. | 1mol氨基(-NH2)中含有电子数目为10NA | |
| C. | 一定条件下,1molN2和3molH2充分反应,转移电子数目为2NA | |
| D. | 常温下,1LPH=3的Al2(SO4)3溶液中,水电离出的H+数目为10-3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫气体能用浓硫酸干燥,是因为二氧化硫无还原性 | |
| B. | 医疗上可用硫酸钡X射线透视肠胃的内服药,是因为硫酸钡不溶于酸 | |
| C. | 将某气体通入品红溶液中,品红溶液褪色,该气体一定是二氧化硫 | |
| D. | 浓H2SO4可以用铝制容器贮存,说明常温下铝与浓H2SO4不反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com