
【题目】下列解释实验过程或事实的反应方程式不正确的是( )
A.熔融烧碱时,不能使用普通石英坩埚:SiO2+2NaOH![]() Na2SiO3+H2O
Na2SiO3+H2O
B.红热的铁丝与水接触,表面形成蓝黑色(或黑色)保护层:3Fe+4H2O(g)![]() Fe3O4+4H2
Fe3O4+4H2
C.在海带灰的浸出液(含有I-)中滴加H2O2得到I2:2I-+H2O2+2H+=I2+O2↑+2H2O
D.“84”消毒液(有效成分NaClO)和“洁厕灵”(主要成分盐酸)混合使用放出氯气: ClO-+Cl-+2H+=Cl2↑+H2O
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】相同温度、相同浓度下的八种溶液,其pH由小到大的顺序如图所示,图中①②③④⑤代表的物质可能分别为
![]()
A. NH4Cl (NH4)2SO4 CH3COONa NaHCO3 NaOH
B. (NH4)2SO4 NH4Cl CH3COONa NaHCO3 NaOH
C. (NH4)2SO4 NH4Cl NaOH CH3COONa NaHCO3
D. CH3COOH NH4Cl (NH4)2SO4 NaHCO3 NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国内某科技研究小组首次提出一种新型的Li+电池体系,该体系正极采用含有I-、Li+的水溶液,负极采用固态有机聚合物,电解质溶液采用LiNO3溶液,聚合物离子交换膜作为隔膜将液态正极和固态负极分隔开(原理示意图如图)。已知:I-+I2![]() I3-,下列有关判断正确的是
I3-,下列有关判断正确的是
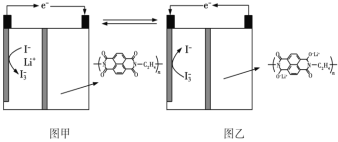
A.图甲是原电池工作原理图,图乙是电池充电原理图
B.放电时,正极液态电解质溶液的颜色加深
C.充电时,Li+从右向左通过聚合物离子交换膜
D.放电时,负极的电极反应式为![]() -2ne-=
-2ne-=![]() +2nLi+
+2nLi+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将等体积的盐酸和氨水分别加水稀释,溶液的导电性与溶液体积的变化曲线如图所示,下列说法正确的是

A. 曲线II表示氨水加水稀释过程中溶液导电性的变化
B. 溶液的pH大小关系:c>b>d
C. 若将bd两点溶液混合,则c(Cl-)>c(NH4+)>c(H+)>c(OH-)
D. 由水电离出n(OH-):b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据《科技日报》报道,我国科学家研制成功一系列石墨烯限域的3d过渡金属中心(Mn、Fe、Co、Ni、Cu)催化剂,在室温条件下以H2O2为氧化剂直接将CH4氧化成C的含氧化合物。请回答下列问题:
(1)在Mn、Fe、Co、Ni、Cu中,某基态原子核外电子排布遵循“洪特规则特例”(指能量相同的原子轨道在全满、半满、全空状态时,体系的能量最低),该原子的外围电子排布式为_____。
(2)在3d过渡金属中,基态原子未成对电子数最多的元素是_____(填元素符号)。
(3)铜的焰色反应呈绿色,在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为_____。
(4)石墨烯限域单原子铁能活化CH4分子中的C-H键,导致C与H之间的作用力_____ (“减弱”或“不变”)。铁晶体中粒子之间作用力类型是_____。
(5)常温下,H2O2氧化CH4生成CH3OH、HCHO、HCOOH等。
①它们的沸点分别为64.7℃、-19.5℃、100.8℃,其主要原因是_____;
②CH4和HCHO比较,键角较大的是_____,主要原因是_____。
(6)钴晶胞和白铜(铜镍合金)晶胞分别如图1、2所示。
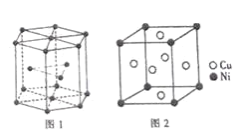
①钴晶胞堆积方式的名称为_____;
②已知白铜晶胞的密度为dg·cm-3,NA代表阿伏加德罗常数的值。图2晶胞中两个面心上铜原子最短核间距为_____ pm(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定有机物中碳和氢的质量分数,常用的方法是燃烧分析法,用氧化铜作催化剂,在750 ℃左右使有机物在氧气流中全部氧化成CO2和H2O,分别用装有固体NaOH和固体Mg(ClO4)2(高氯酸镁)的吸收管吸收CO2和H2O。某课外活动小组,设计用下列装置制取乙烯,并测定乙烯分子中碳、氢原子个数比,甲为燃烧管,当乙烯和氧气通过时,由于催化剂的存在而不会发生爆炸,乙烯将被氧化成CO2和H2O。
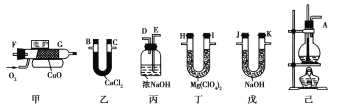
请回答下列问题:
(1)整套装置的连接顺序(按从左到右顺序用字母填写): ____接____,____接____,____接____,____接____,____接___.
(2)烧瓶中的试剂是浓H2SO4和酒精,其中浓H2SO4的作用是___________,在烧瓶中还要加少量碎瓷片,其作用是__________。
(3)实验时应使烧瓶中溶液温度迅速升至170 ℃,原因是____________________。实验结束时,烧瓶中有黑色物质生成,其原因是__________。
(4)乙、丙装置的作用分别是:乙:____________________;丙:_____________________。
(5)若实验前后,丁增重a g,戊增重b g,则测得乙烯分子中C、H原子个数比为__________。
(6)若测得C/H值偏高,导致这种误差的可能原因是(_____)
A.乙烯中混有少量乙醚(C2H5OC2H5)
B.乙烯进入燃烧管时,仍含有少量水蒸气
C.乙烯中混有少量CO
D.乙烯进入燃烧管时,仍含有少量CO2
(7)若仍用上述装置测定某烃A的化学式,经测定丁增重4.5 g,戊增重8.8 g,则A的最简式为__________;若要确定A的化学式,是否还需要其他数据(若需要,说明还需测定哪些数据;若不需要,说明其原因)?_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)一定温度下,在容积固定的密闭容器中进行的可逆反应:2NO2![]() 2NO+O2,达到平衡的标志是
2NO+O2,达到平衡的标志是
①相同时间内,氧气的生成速率为n mol·L-1·s-1,NO2的生成速率为2n mol·L-1·s-1
②单位时间内生成n mol O2的同时生成2n mol的NO
③混合气体的颜色不再变化 ④混合气体的密度保持不变
⑤混合气体的平均相对分子质量不再改变 ⑥压强不随时间变化而变化
A. ①③⑤⑥ B. ②③⑤
C. ①③④ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按系统命名法命名下列各物质。
①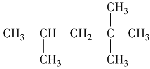 _____________________
_____________________
②(CH3)2CH—CH2—CH2—CH2—CH3_____________________
③![]() ____________________
____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电解法处理硼酸铵料液(主要成分为分离出铵盐及硼酸的装置如图所示。装置工作时,下列说法错误的是( )
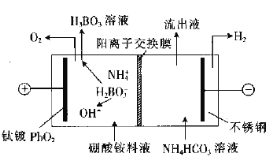
已知:NH4H2BO3易溶于水,硼酸为弱酸。
A.从阳极室迁移至阴极室的主要离子是H+
B.阳极室电极周围溶液的pH不断减小
C.阴极室流出液中含NH4HCO3和(NH4)2CO3
D.阳极区溶液中发生的反应之一为H2BO3-+H2O=H3BO3+OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com