
| 阳离子 | H+、Na+、Al3+、Ag+、Ba2+ |
| 阴离子 | OH-、Cl-、CO32-、NO3-、SO42- |
分析 ①A、B两溶液呈碱性,结合离子的共存可知,应为Ba(OH)2、Na2CO3中的一种,C、D、E溶液呈酸性,应为AgNO3、硫酸铝、HCl中的一种;
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生,则A为Na2CO3,B为Ba(OH)2,E为Al2(SO4)3,C为HCl;
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀,则D为AgNO3,然后结合物质的性质及化学用语来解答.
解答 解:①A、B两溶液呈碱性,结合离子的共存可知,应为Ba(OH)2、Na2CO3中的一种,C、D、E溶液呈酸性,应为AgNO3、硫酸铝、HCl中的一种;
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生,则A为Na2CO3,B为Ba(OH)2,E为Al2(SO4)3,C为HCl;
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀,则D为AgNO3,
(1)根据以上分析可知A为Na2CO3,碳酸钠溶液水解呈碱性,离子反应方程式为:CO32-+H2O?HCO3-+OH-,
故答案为:CO32-+H2O?HCO3-+OH-;
(2)根据分析可知,D为AgNO3,E为Al2(SO4)3,
故答案为:AgNO3;Al2(SO4)3.
点评 本题考查离子的检验方法,为高频考点,题目难度中等,把握离子之间的反应、盐类水解等推断物质为解答的关键,侧重化学反应原理的考查,综合性较强,充分考查了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 5.6 g铁与足量盐酸反应转移的电子数为0.3NA | |
| B. | 常温常压下,11.2L二氧化硫中含有的氧原子数为NA | |
| C. | 常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA | |
| D. | 标准状况下,22.4 L氦气与22.4 L氮气所含原子数均为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在容积为VL的密闭容器中发生2NO2?2NO+O2反应.反应过程中NO2的物质的量随时间变化的状况如图所示.
在容积为VL的密闭容器中发生2NO2?2NO+O2反应.反应过程中NO2的物质的量随时间变化的状况如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往溶液中加入浓溴水,出现白色沉淀,说明含有苯酚 | |
| B. | 向含酚酞的氢氧化钠溶液中加入溴乙烷,加热后红色变浅,说明溴乙烷发生了水解 | |
| C. | 在制备乙酸乙酯后剩余的反应液中加入碳酸钠溶液,产生气泡,说明还有乙酸剩余 | |
| D. | 将乙醇和浓硫酸共热后得到的气体通入溴水中,溴水褪色,说明生成了乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
实验 | 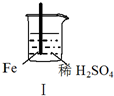 | 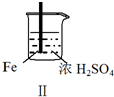 | 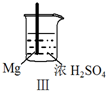 | 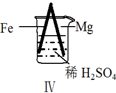 |
现象 | Fe表面产生大量无色气泡 | Fe表面产生气泡后迅速停止 | Mg表面迅速产生大量气泡 | Fe表面有大量气泡,Mg表面有少量气泡 |
| A. | I中产生气体的原因是:Fe+2H+═Fe2++H2↑ | |
| B. | 取出Ⅱ中的铁棒放入CuSO4溶液立即析出亮红色固体 | |
| C. | Ⅲ中现象说明Mg在浓H2SO4中没被钝化 | |
| D. | Ⅳ中现象说明Mg的金属性比Fe强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳的燃烧热大于110.5 kJ•mol-1 | |
| B. | ①的反应热为221 kJ•mol-1 | |
| C. | 浓硫酸与稀NaOH溶液反应的成1 mol水,放出57.3 kJ热量 | |
| D. | 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合金的硬度一般比它的各成分金属的小,多数合金的熔点一般也比它的各成分金属的高 | |
| B. | 合金在工业上具有比纯金属更广泛的用途 | |
| C. | 制饭勺、饭盒、高压锅等的不锈钢是合金 | |
| D. | 青铜是我国使用最早的合金 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com