
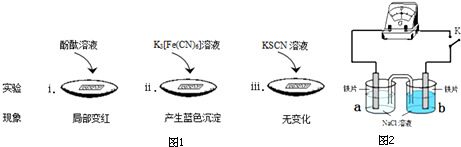
| 实验 | a | b | 指针偏转方向 |
| Ⅰ | 0.1% | 0.01% | 向右 |
| Ⅱ | 0.1% | 3.5% | 向左 |
| Ⅲ | 3.5% | 饱和溶液 | 向右 |
分析 (1)铁、碳以氯化钠溶液为电解质形成原电池,发生吸氧腐蚀生成氢氧根离子,溶液显碱性,遇到酚酞变红;
(2)①K3[Fe(CN)6]溶液与二价铁离子反应生成蓝色沉淀;
②温度升高,Fe还原性增强,反应速率加快;
(3)①依据不同浓度下,检流计指针偏转方向判断电极,书写电极反应式;
②要证明在饱和NaCl溶液中O2浓度较低,钢铁不易被腐蚀,可以设计对比试验,一个实验中通入氧气,另一个实验中不通入氧气,观察铁的腐蚀情况;
(4)依据上述实验总结归纳解答.
解答 解:(1)①铁、碳以氯化钠溶液为电解质形成原电池,酚酞变红说明生成氢氧根离子,发生吸氧腐蚀,故答案为:O2;
②铁与碳以氯化钠溶液为电解质形成原电,铁做原电池负极,碳做正极,故答案为:与铁组成原电池,作原电池的正极;
③为了说明NaCl的作用,需要补充的对照实验是,用水做电解质,代替氯化钠进行上述实验,故答案为:用水代替NaCl溶液进行上述实验;
(2)①K3[Fe(CN)6]溶液与二价铁离子反应生成蓝色沉淀,而取a、b中溶液少量,滴加K3[Fe(CN)6]溶液,a中出现蓝色沉淀,说明a中生成二价铁离子,b中无变化,b中没有二价铁离子生成,所以a做负极,b做正极;
故答案为:正;
②加热后,指针发生偏转的原因可能是:温度升高,Fe还原性增强,反应速率加快;
故答案为:温度升高,Fe还原性增强,反应速率加快;
(3)①依据图表中Ⅱ组数据及指针向左偏转,则可知:b极为负极,失去电子发生氧化反应,电极反应式:Fe-2e-=Fe2+;
故答案为:Fe-2e-=Fe2+;
②要证明氧气浓度对金属腐蚀速率的影响,可以设计对比实验,如下:另取两个烧杯,分别往其中加入铁片和一定量的饱和NaCl溶液,再分别滴加几滴K3Fe(CN)6溶液,然后往其中一个烧杯中通入O2,观察现象;
故答案为:另取两个烧杯,分别往其中加入铁片和一定量的饱和NaCl溶液,再分别滴加几滴K3Fe(CN)6溶液,然后往其中一个烧杯中通入O2,观察现象;
(4)通过上述实验可知:对钢铁腐蚀有影响的因素是有温度、NaCl溶液的浓度、O2的浓度;
故答案为:温度、NaCl溶液的浓度、O2的浓度.
点评 本题为实验题,考查了金属腐蚀速率的影响因素,明确原电池工作原理是解题关键,注意实验设计严密性,题目难度中等.


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:选择题
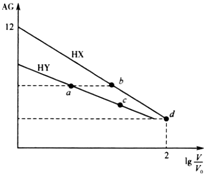 常温下,浓度均为0.10mol•L-1、体积均为V0的HX和HY溶液,分别加水稀释至体积V,AG[AG=$\frac{c({H}^{+})}{c(O{H}^{-})}$]随1g$\frac{V}{{V}_{0}}$的变化如图所示.下列叙述正确的是( )
常温下,浓度均为0.10mol•L-1、体积均为V0的HX和HY溶液,分别加水稀释至体积V,AG[AG=$\frac{c({H}^{+})}{c(O{H}^{-})}$]随1g$\frac{V}{{V}_{0}}$的变化如图所示.下列叙述正确的是( )| A. | a、b溶液中导电离子数目相等 | |
| B. | 水的电离程度:a<b<c | |
| C. | d点所示溶液的AG=8 | |
| D. | 与等浓度的NaOH溶液中和时,c点消耗NaOH溶液的体积大于a点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
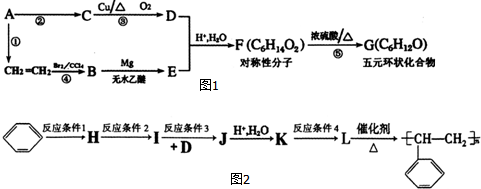
 .
.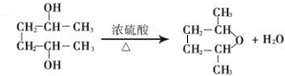 .
.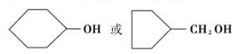 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A.秦朝铜车马 | B.春秋越王剑 | C.唐三彩 | D.商代司母戊鼎 |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
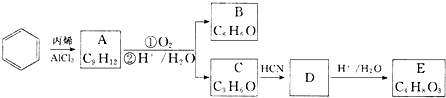
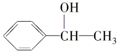
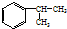 ,A的含有苯环的同分异构体(除A外)有7种.
,A的含有苯环的同分异构体(除A外)有7种.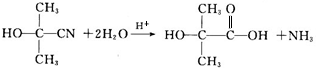 .
.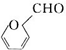 )是一种重要的化工原料,如同甲醛与苯酚反应生成酚醛树脂,它也可与苯酚反应生成糠醛树脂,写出该反应的化学方程式:
)是一种重要的化工原料,如同甲醛与苯酚反应生成酚醛树脂,它也可与苯酚反应生成糠醛树脂,写出该反应的化学方程式: .
. ,G
,G .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
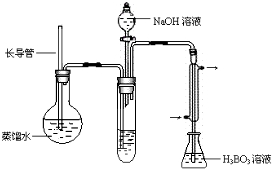
| 实验编号 | 样品和辅助试剂 | 消耗盐酸体积(mL) |
| 1 | 10.00mL溶液、0.1g催化剂、20mL浓硫酸 | 33.18 |
| 2 | 10.00mL溶液、0.1g催化剂、20mL浓硫酸 | 33.70 |
| 3 | 10.00mL溶液、0.1g催化剂、20mL浓硫酸 | 33.22 |
| 4 | x |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCl2中含有Cl2分子的数目为NA | |
| B. | 标准状况下,22.4L水中含有水分子数目为NA | |
| C. | 含有 1molNa2SO4的溶液中含有钠离子数目为NA | |
| D. | 32gO2中含有氧原子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 麦芽糖和蔗糖的水解产物相同 | |
| B. | 用新制的氢氧化铜可区分乙醇、乙醛 | |
| C. | 用高锰酸钾酸性溶液可以区分苯、甲苯 | |
| D. | 用饱和溴水可区分苯酚溶液、己烷、1-己烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com