
| A. | 生成了氢氧化铁沉淀 | |
| B. | 体系中存在着氢氧化铁的沉淀溶解平衡 | |
| C. | 溶液中不再存在Fe3+ | |
| D. | 加入少量盐酸,则溶液中Fe3+浓度会上升 |
分析 A、氯化铁和氢氧化钠反应生成红褐色沉淀氢氧化铁;
B、沉淀形成在溶液中存在溶解沉淀平衡;
C、存在氢氧化铁溶解沉淀平衡,一定含有铁离子;
D、氢氧化铁溶解于盐酸溶液中铁离子浓度增大;
解答 解:A、氯化铁和氢氧化钠反应生成红褐色沉淀氢氧化铁,Fe3++3OH-=Fe(OH)3↓,故A正确;
B、沉淀形成在溶液中存在溶解沉淀平衡,Fe(OH)3(s)?Fe3+(aq)+3OH-(aq),故B正确;
C、存在氢氧化铁溶解沉淀平衡,一定含有铁离子,故C错误;
D、氢氧化铁溶解于盐酸溶液中,Fe(OH)3+3H+=Fe3++3H2O,铁离子浓度增大,故D正确;
故选C.
点评 本题考查了沉淀形成,沉淀溶解平衡的理解应用,掌握基础是关键,题目较简单.


科目:高中化学 来源: 题型:多选题
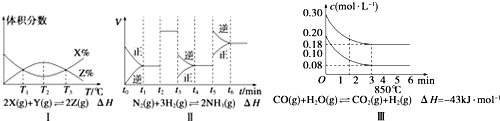
| A. | 由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的△H<0 | |
| B. | 由图Ⅱ知,反应在t6时刻,NH3体积分数最大 | |
| C. | 由图Ⅱ知,t3时采取降低反应体系压强的措施 | |
| D. | 图Ⅲ表示在10 L容器、850℃时的反应,由图知,到4 min时,反应放出51.6 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:纯碱>石灰石>小苏打>碳酸 | |
| B. | 除Li外其它碱金属单质均可以保存在煤油中 | |
| C. | 碱金属都是活泼的金属元素,其盐都不发生水解 | |
| D. | 最高氧化物对应水化物碱性LiOH<NaOH<KOH<RbOH<CsOH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
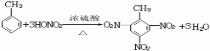 ,此反应属于取代反应,其生成物的名称是2.4.6-三硝基甲苯
,此反应属于取代反应,其生成物的名称是2.4.6-三硝基甲苯查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1>Q2,Q2=2Q3 | B. | Q1=Q2=Q3 | C. | Q1<Q2,Q3=$\frac{{Q}_{1}}{2}$ | D. | 无法比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
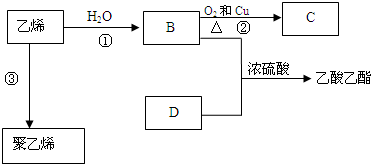
 .
. 反应类型:加聚反应
反应类型:加聚反应查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com