
分析 (1)盐酸与碳酸钾反应生成氯化钾和水、二氧化碳;
(2)氧化铝能够与氢氧化钠反应生成可溶性偏铝酸钠和水;
(3)碳酸氢钠不稳定,受热分解生成碳酸钠和水、二氧化碳;
(4)①铝与氢氧化钠溶液反应生成偏铝酸钠和氢气;
②NaHSO4溶液与Ba(OH)2溶液充分混合.溶液显中性,二者反应比例物质量之比为2:1;
③二价铁离子还原性强于溴离子,氯气先氧化二价铁离子,再氧化溴离子;
(5)甲厂废水呈碱性,则溶液中含有大量的OH-,与OH-离子反应的Ag+、Fe3+不能大量共存,根据溶液电中性可知甲厂废水中应含有K+,乙厂中含有Ag+、Fe3+,溶液显黄色,则与Ag+、Fe3+反应的Cl-、OH-不能共存,根据溶液电中性可知乙厂还有NO3-.
解答 解:(1)盐酸与碳酸钾反应生成氯化钾和水、二氧化碳,除去氯化钾中碳酸钾可用盐酸,离子方程式:2H++CO32-=CO2↑+H2O;
故答案为:盐酸;2H++CO32-=CO2↑+H2O;
(2)氧化铝能够与氢氧化钠反应生成可溶性偏铝酸钠和水,所以除去混入Fe2O3溶液中少量Al2O3杂质的试剂可以为氢氧化钠溶液,反应的离子方程式:Al2O3+2OH-=2AlO2-+H2O;
故答案为:氢氧化钠溶液;Al2O3+2OH-=2AlO2-+H2O;
(3)碳酸氢钠不稳定,受热分解生成碳酸钠和水、二氧化碳,所以除去Na2CO3粉末中混入的NaHCO3杂质用加热的方法,方程式:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,
故答案为:加热;2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;
(4)①铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,除去铁粉中混有的铝粉可用氢氧化钠溶液,离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑;
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
②NaHSO4溶液与Ba(OH)2溶液充分混合.溶液显中性,离子方程式:Ba2++2OH-+2H++SO42-=2H2O+BaSO4↓;
故答案为:Ba2++2OH-+2H++SO42-=2H2O+BaSO4↓;
③向含0.6mol的FeBr2溶液中通入0.8mol Cl2,二价铁离子全部被氧化,溴离子部分被氧化,离子方程式:8Cl2+10Br-+6Fe2+═6Fe3++16Cl-+5Br2;
故答案为:8Cl2+10Br-+6Fe2+═6Fe3++16Cl-+5Br2;
(5)甲厂废水呈碱性,则溶液中含有大量的OH-,与OH-离子反应的Ag+、Fe3+不能大量共存,
根据溶液电中性可知甲厂废水中应含有K+,乙厂中含有Ag+、Fe3+,则与Ag+、Fe3+反应的Cl-、OH-不能共存,根据溶液电中性可知乙厂还有NO3-,
由此可知:甲厂含有K+、Cl-、OH-,溶液显碱性,乙厂含有Ag+、Fe3+、NO3-,溶液呈黄色,
故答案为:碱;黄;Ag+、Fe3+、NO3-.
点评 本题为综合题,涉及物质的除杂与净化、离子方程式的书写、离子推断,明确离子反应条件及反应实质是解题关键,题目难度中等.


 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 硫酸溶液中和氢氧化钠溶液 | B. | 硫酸溶液中和氢氧化钡溶液 | ||
| C. | 盐酸溶解氧化铜 | D. | 盐酸溶解氢氧化镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的或结论 |
| A | 向某溶液中加入BaCl2溶液,再加入盐酸 | 证明溶液中是否含SO42- |
| B | 加热铝箔,熔化的铝不滴落 | 铝表面的氧化膜熔点高,包在熔化的铝外面 |
| C | Cl2能使湿润的紫色石蕊试纸先变红后褪色 | Cl2具有漂白性 |
| D | 将SO2通入品红溶液中,品红溶液褪色,加热褪色后的品红溶液,溶液恢复红色 | 验证亚硫酸的不稳定性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
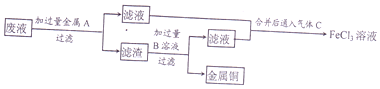
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水 | B. | 硝酸 | C. | 酒精 | D. | 醋 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 5 | 15 | 25 | 35 | ||
| n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 | ||
| A. | 前 5 s 的平均反应速率v(A)=0.03 mol•L-1•s-1 | |
| B. | 正反应是吸热反应 | |
| C. | 保持温度不变,起始时向容器中充入2molC,达平衡时,C的转化率大于80% | |
| D. | 保持温度不变,起始时向容器中充入0.2molA、0.2molB?和1molC,反应达到平衡前v(正)<v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.35mol•L-1•min-1 | B. | v(B)=0.01mol•L-1•s-1 | ||
| C. | v(C)=0.40mol•L-1•min-1 | D. | v(D)=0.45mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠投入CuSO4溶液中 | B. | 过量的NaOH溶液和明矾溶液反应 | ||
| C. | 金属钠投入MgSO4溶液中 | D. | 金属铝投入NaOH溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体形状不变 | B. | 晶体溶解,溶液的浓度变大 | ||
| C. | 晶体不溶解,溶液浓度不变 | D. | 晶体形状改变,溶液浓度不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com