
【题目】工业上生产铬单质涉及的反应如下:
Na2Cr2O7+2C![]() Cr2O3+Na2CO3+CO↑
Cr2O3+Na2CO3+CO↑
Cr2O3+2Al![]() 2Cr+Al2O3
2Cr+Al2O3
(1) Cr基态原子的核外电子排布式为________。
(2) Na、O、C的第一电离能从大到小的顺序为________。
(3) 与CO![]() 互为等电子体的一种分子为________(填化学式)。
互为等电子体的一种分子为________(填化学式)。
(4) Cr2O3具有两性,溶于NaOH溶液形成配合物Na[Cr(OH)4]。
Na[Cr(OH)4]中配体的化学式为____________,1 mol该配合物中含σ键数目为_________。
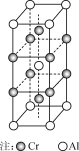
(5) 合金CrAl晶体的晶胞如右图所示,写出该合金的化学式:________。
【答案】[Ar]3d54s1 O>C>Na SO3或BF3或COCl2 OH- 8×6.02×1023或8 mol Cr2Al或AlCr2
【解析】
(1)Cr位于第四周期ⅥB,其核外电子排布式可写成![]() ;
;
(2)同周期元素第一电离能从左至右,呈现增大的趋势;同主族元素第一电离能从上至下,呈现减小的趋势;因此三种元素第一电离能从大到小的顺序为O>C>Na;
(3)![]() 带有两个负电荷,因此与其互为等电子体的分子可以为SO3或BF3或COCl2等;
带有两个负电荷,因此与其互为等电子体的分子可以为SO3或BF3或COCl2等;
(4)配体是具有孤对电子,在形成配位键时可以作为电子对的给予体的分子或离子,OH-是![]() 的配体;
的配体;![]() 中Na+和
中Na+和![]() 之间是离子键,1个
之间是离子键,1个![]() 中有4个配位键,因此1mol
中有4个配位键,因此1mol![]() 中含有σ键4+4=8mol;
中含有σ键4+4=8mol;
(5)由Cr-Al合金的晶胞结构可知,Cr原子在晶胞的4条棱上各自有两个,并且在内部也有两个,所以一个晶胞中Cr原子的数目为:![]() ;Al原子在晶胞的8个顶点上,并且内部也有一个,所以一个晶胞中Al原子的数目为:
;Al原子在晶胞的8个顶点上,并且内部也有一个,所以一个晶胞中Al原子的数目为:![]() ;所以合金的化学式为Cr2Al。
;所以合金的化学式为Cr2Al。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】(1)关于反应H2(g)+![]() O2(g)===H2O(l),下列说法正确的是________(填字母)。
O2(g)===H2O(l),下列说法正确的是________(填字母)。
A.焓变ΔH<0,熵变ΔS<0
B.可以把反应设计成原电池,实现能量的转化
C.该反应在常温下不易被观察,因为具有较高的活化能,反应速率小
D.选用合适的催化剂,有可能使反应在常温常压下以较快的速率进行
(2)电渗析法淡化海水装置示意图如图所示,在电场中利用膜技术可以实现淡化海水和浓缩海水的分离。

①图中膜a应选用________(填“阳离子”或“阴离子”)交换膜。
②各间隔室的排出液中,A为________(填“淡化海水”或“浓缩海水”)。
③电渗析法还可用来处理电镀废液,写出用该方法处理含AgNO3废液时所发生反应的化学反应方程式:______。
(3)水在高温高压状态下呈现许多特殊的性质。当温度、压强分别超过临界温度(374.2 ℃)、临界压强(22.1 MPa)时的水称为超临界水。
①如果超临界水的电离度变为常温下的100倍,则此时Kw的值为____。
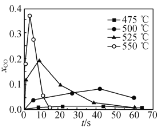
②超临界水能够与氧气等氧化剂以任意比例互溶,由此发展了超临界水氧化技术。一定实验条件下,测得乙醇的超临界水氧化结果如图,其中x为以碳元素计的物质的量分数,如xCO=![]() ,t为反应时间。 CO的分布分数先增后降的原因是___。
,t为反应时间。 CO的分布分数先增后降的原因是___。

③不同温度下乙醇的超临界水氧化过程中CO的分布分数随时间变化如图所示,随着温度升高,CO分布分数峰值出现的时间提前且峰值更高的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,如图所示装置可实现有机物的电化学储氢,将10 mol由苯和环已烷组成的混合气体通入反应器中,下列说法不正确的是
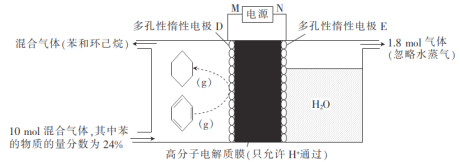
A.N为电源的正极
B.H+从右向左移动
C.D电极上的电极反应式为![]()
D.苯的转化率为50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
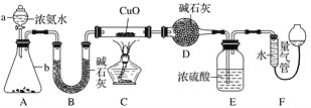
(1)仪器a的名称为______;仪器b中可选择的试剂为______。
(2)实验室中,利用装置A,还可制取的无色气体是______(填字母)。
A.Cl2 B.O2 C.CO2 D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有______性,写出相应的化学方程式______。
(4)E装置中浓硫酸的作用______。
(5)读取气体体积前,应对装置F进行的操作:______。
(6)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为______(用含m、n字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中医经典方剂组合对“COVID-19”的治疗显示出良好的临床疗效。其中有效成分之一黄芩苷结构简式如图所示,下列说法错误的是

A.黄芩苷可发生取代、加成、氧化、还原反应B.黄芩苷是芳香族化合物,其分子式为C21 H16 O11
C.黄芩苷分子中苯环上的一氯代物只有4种D.1 mol黄芩苷最多能消耗3mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置.下列叙述不正确的是

A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为:Cu2++2e-=Cu
C. 无论a和b是否连接,铁片均会溶解
D. a和b用导线连接后,Fe片上发生还原反应,溶液中的Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有以下物质的相互转化:

试回答:
(1)B的化学式为_____;D的化学式为_____。
(2)写出由E转变成F的化学方程式:______。
(3)常用____(填试剂名称)检验G中的阳离子,其现象为______。
(4)向G溶液中加入A的有关反应的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组制备84消毒液(主要成分NaClO)设计了如图装置。并查阅到下列资料:
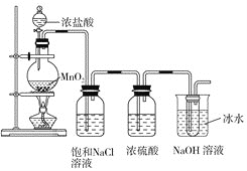
Ⅰ.氯气与水的反应是放热反应;
Ⅱ.卤素单质与碱液发生反应:3X2+6OH-![]() 5X-+XO3-+3H2O。
5X-+XO3-+3H2O。
回答下列问题:
(1)装置中的大试管内发生反应的离子方程式为__。
(2)装置中能否省去盛饱和NaCl溶液的洗气瓶?__(填“能”或“不能”,下同),理由是__。
(3)装置中能否省去盛浓硫酸的洗气瓶?__,理由是__。
(4)装置中能否省去盛冰水的烧杯?__,理由是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对化学反应方向的说法,正确的是
A.同一物质的固、液、气三种状态的熵值递减
B.常温下反应2Na2SO3(s)+O2(g)=2Na2SO4(s)能自发进行,则△H<0
C.CaCO3(s)=CaO(s)+CO2(g)△H>0,△S>0,不论在何种条件下都不可能自发
D.因为焓变和熵变都与反应的自发性有关,因此焓变或墒变均可以单独做为判断反应能否自发进行的判据
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com