
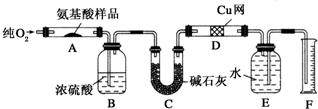
分析 该实验原理为:Wg该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2.装置B内盛放浓硫酸,吸收生成的水,根据装置B增重,确定Wg该种氨基酸中含氢元素质量,根据F中水的体积确定氮气的体积,并由此确定待测氨基酸中含有的氮元素的质量,再计算氧元素的质量,确定分子中元素原子个数比,由此确定最简式.
(1)利用排水法测定氮气的体积,确定Wg该种氨基酸中含氮元素质量;
(2)氨基酸和氧气的反应,以及铜网和氧气的反应都需要加热;
(3)氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气;
(4)由原理可知,铜网吸收未反应的O2.
解答 解:该实验原理为:Wg该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2.装置B内盛放浓硫酸,吸收生成的水,根据装置B增重,确定Wg该种氨基酸中含氢元素质量,根据F中水的体积确定氮气的体积,并由此确定待测氨基酸中含有的氮元素的质量,在计算氧元素的质量,确定分子中元素原子个数比,由此确定最简式.
(1)装置的空气中含有N2,影响生成氮气的体积测定,需将装置中的N2排净,
故答案为:将装置中的N2排净;
(2)氨基酸和氧气的反应,以及铜网和氧气的反应都需要加热,应先点燃D处的酒精灯,吸收未反应的氧气,保证最终收集的气体为N2
故答案为:AD;D;
(3))氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气,反应的化学方程式是:CxHyOzNm+(x+$\frac{y}{4}$-$\frac{z}{2}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O+$\frac{m}{2}$N2,
故答案为:CxHyOzNm+(x+$\frac{y}{4}$-$\frac{z}{2}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O+$\frac{m}{2}$N2;
(4)由原理可知,铜网吸收未反应的氧气,保证最终收集的气体为N2;
故答案为:吸收未反应的氧气,保证最终收集的气体为N2.
点评 本题考查学生利用燃烧法确定有机物分子组成的知识,为高频考点,侧重于学生的分析、实验和计算能力的考查,注意根据原子守恒法来解答,难度不大,关键在于理解实验原理.


 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:选择题
| A. | “绿色化学”的理念是从源头上减少和消除工业产生对环境的污染 | |
| B. | 氢能是清洁能源,工业上电解水法制大量氢气符合节能减排理念 | |
| C. | 如将纳米材料分散到液体分散剂中,该分散系可发生丁达尔现象,由此可推测纳米材料的直径为1~100nm之间 | |
| D. | 将苦卤浓缩、氧化,鼓入热空气或水蒸气提取海水中的溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH | B. | ZnO | C. | Na2CO3 | D. | Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核都是由质子和中子构成的 | |
| B. | 不同元素原子的质量数一定不等 | |
| C. | 质子数决定元素种类,质子数和中子数决定原子种类 | |
| D. | 质子数相同的粒子,其核外电子数一定相同,但化学性质不一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶格能 NaCl<MgO | B. | 熔点:NH3<PH3 | ||
| C. | 离子半径:Na+<O2- | D. | 第一电离能:Mg>Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水电离出的c(H+)•c(OH-)═10-22的溶液:Mg2+、K+、Br-、HCO3- | |
| B. | 滴入少量KSCN溶液显红色的溶液中:Na+、K+、I-、NO3- | |
| C. | 使pH试纸呈蓝色的溶液:Na+、AlO2-、SO42-、Cl- | |
| D. | 使甲基橙变红的溶液:Ca2+、NH4+、CH3COO-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com