
分析 (1)同温同压下,等体积的O2和O3的物质的量相同,根据m=nM计算质量之比,密度之比等于质量比,结合分子组成分析;
(2)根据质量守恒计算C的质量,再根据M=$\frac{m}{n}$计算C的摩尔质量;
(3)在温度和密度都相同条件下,如体积相同,则质量相同,气体的物质的量越大,压强越大,压强与摩尔质量成反比;
(4)氢离子与碳酸根离子反应生成二氧化碳气体;银离子能够与Cl-、SO42-、CO32-沉淀.
解答 解:(1)同温同压下,等体积的O2和O3的物质的量相同,设物质的量均为n,
物质的量之比等于分子数之比为1:1;
则质量比为32n:48n=2:3,
密度之比等于质量比11:12,
故答案为:1:1;2:3;
(2)根据质量守恒定律知,C的质量=(16+20-31.76)g=4.24g,C的摩尔质量=$\frac{4.24g}{0.04mol}$=106g/mol,
故答案为:106g/mol;
(3)Ne的摩尔质量是20g/mol,氢气的摩尔质量是2g/mol,氧气的摩尔质量是32g/mol,在温度和密度都相同条件下,压强与摩尔质量成反比,所以其压强大小顺序是P(H2)>P(Ne)>P (O2),
故答案为:P(H2)>P(Ne)>P (O2);
(4)当溶液中有大量H+存在时,CO32-能够与氢离子发生反应,在溶液中不能大量共存,银离子能够与Cl-、SO42-、CO32-沉淀,若溶液中存在银离子,则三种离子都不能共存;
故答案为:CO32-;Cl-、SO42-、CO32-.
点评 本题考查物质的量的有关计算、离子共存,把握质量、体积、物质的量、微粒数的关系以及离子间的反应为解答的关键,侧重分析能力及计算能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
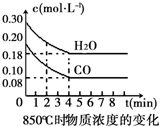 在一体积为10L的容器中,通入一定量的CO和H2O(g),在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g).CO和H2O(g)浓度变化如图
在一体积为10L的容器中,通入一定量的CO和H2O(g),在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g).CO和H2O(g)浓度变化如图| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0J062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol任何物质所含有的原子数都相同 | |
| B. | 摩尔是物质的量的单位,简称摩,符号为mol | |
| C. | 摩尔可以把物质的宏观数量与微观粒子的数量联系起来 | |
| D. | 国际上规定,0.012 kg C中所含有的碳原子数目为1摩 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
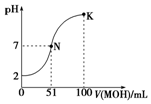 常温下,向100mL 0.01mol•L-1 HA溶液中逐滴加入0.02mol•L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:
常温下,向100mL 0.01mol•L-1 HA溶液中逐滴加入0.02mol•L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com