
分析 (1)常温下,将1mL pH=1的H2SO4溶液加水稀释到100mL,溶液体积增大100倍,溶液中c(H+)降为原来的$\frac{1}{100}$,稀释后溶液的pH=pH(原来)+2,但酸无论如何稀释,稀释后pH<7;
(2)某温度时,测得0.01mol•L-1的NaOH溶液的pH为11,该溶液中c(OH-)=0.01mol/L、c(H+)=10-pH=10-11 mol/L,KW=c(OH-).c(H+);升高温度,促进水电离,水的离子积常数增大;
(3)常温下,pH=13的Ba(OH)2溶液中c(OH-)=0.1mol/L,pH=3的H2SO4溶液c(H+)=0.001mol/L,
若所得混合溶液呈中性,说明酸中n(H+)等于碱中n(OH-),即0.001b=0.1a;
若所得混合溶液pH=12,则混合溶液中c(OH-)=0.01mol/L=$\frac{0.1a-0.001b}{a+b}$mol/L;
(4)在(2)所述温度下,将pH=a的NaOH溶液VaL与pH=b的硫酸VbL混合.
①若所得混合溶液为中性,且a=12,b=2,根据c(OH-)×Va=c(H+)×Vb计算;
②若所得混合溶液的pH=10,碱过量,计算出c(OH-)与酸碱的物质的量的关系,可计算.
解答 解:(1)常温下,将1mL pH=1的H2SO4溶液加水稀释到100mL,溶液体积增大100倍,溶液中c(H+)降为原来的$\frac{1}{100}$,稀释后溶液的pH=pH(原来)+2,但酸无论如何稀释,稀释后pH<7,所以稀释后溶液的pH=1+2=3,
故答案为:3;
(2)某温度时,测得0.01mol•L-1的NaOH溶液的pH为11,该溶液中c(OH-)=0.01mol/L、c(H+)=10-pH=10-11 mol/L,KW=c(OH-).c(H+)=0.01×10-11=10-13>10-14,升高温度,促进水电离,水的离子积常数增大,所以该温度高于25℃,
故答案为:10-13;高于;
(3)常温下,pH=13的Ba(OH)2溶液中c(OH-)=0.1mol/L,pH=3的H2SO4溶液c(H+)=0.001mol/L,
若所得混合溶液呈中性,说明酸中n(H+)等于碱中n(OH-),即0.001b=0.1a,a:b=1:100;
若所得混合溶液pH=12,则混合溶液中c(OH-)=0.01mol/L=$\frac{0.1a-0.001b}{a+b}$mol/L,a:b=11:90,
故答案为:1:100;11:90;
(4)在(2)所述温度下,将pH=a的NaOH溶液VaL与pH=b的硫酸VbL混合.
①若所得混合溶液为中性,且a=12,b=2,因c(OH-)×Va=c(H+)×Vb,a=12,b=2,则0.1×Va=0.01Vb,则Va:Vb=1:10,故答案为:1:10;
②若所得混合溶液的pH=10,碱过量,c(OH-)=$\frac{0.1{V}_{a}-0.01{V}_{b}}{{V}_{a}+{V}_{b}}$=0.001,则Va:Vb=1:9,故答案为:1:9.
点评 本题考查酸碱混合的计算,综合考查学生的计算能力和分析能力,注意把握相关计算公式,注意水的离子积常数与温度的关系,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | NH4+、SO42-、Al3+、Cl- | B. | Na+、OH-、K+、Cl- | ||
| C. | MnO4-、K+、SO42-、Na+ | D. | K+、NO3-、I-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
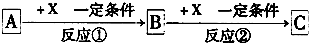
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | A-B之前 | B. | B-C间 | C. | C-D间 | D. | D-E间 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取11.7 g CuO粉末 | |
| B. | 用100 mL量筒量取5.26 mL稀硫酸溶液 | |
| C. | 温度计上显示的室温读数为25.68℃ | |
| D. | 用广泛pH试纸测得溶液的pH为3.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
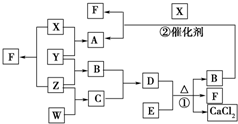 X、Y、Z、W均为气体单质,A、B、C均为无色气体化合物,D、E均为白色固体,F在通常情况下为无色无味的液体,它们有如下的转化关系:
X、Y、Z、W均为气体单质,A、B、C均为无色气体化合物,D、E均为白色固体,F在通常情况下为无色无味的液体,它们有如下的转化关系: ,F中的化学键类型为共价键.
,F中的化学键类型为共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘易升华,应该密封保存 | |
| B. | 液溴应保存在磨口玻璃塞深棕色细口试剂瓶中,并加少量水进行水封 | |
| C. | 酒精与水互溶,所以不能用酒精把碘从碘水中萃取出来 | |
| D. | 用加热的方法可以将NH4Cl与碘的混合物分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 耐高温材料 | B. | 耐压材料 | C. | 复合材料 | D. | 耐腐蚀材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2和Cl2混合通入水中后可能使品红褪色 | |
| B. | 二氧化硫的排放会导致光化学烟雾和酸雨的产生 | |
| C. | 单质硫在自然界只以化合态存在 | |
| D. | 浓硫酸可用来干燥SO2、CO、Cl2等气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com