
【题目】实验测得常温下0.1mol/L某一元酸HA溶液的pH≠1,0.1mol/L某一元碱BOH溶液里![]() 。将此两种溶液等体积混合后,所得溶液呈的各离子浓度间关系正确的是( )
。将此两种溶液等体积混合后,所得溶液呈的各离子浓度间关系正确的是( )
A.c (A-)>c (B+)>c (H+)>c (OH-)
B.c (B+)=c (A-)>c (H+)=c (OH-)
C.c (OH-)- c (H+)=c(HA)
D.c (B+)+ c (H+)=c (A-)+c (OH-) + c(HA)
【答案】C
【解析】
试题分析:常温下0.1mol/L某一元酸HA溶液的pH≠1,说明HA是弱酸,在溶液中存在电离平衡:HA![]() H++A-,0.1mol/L某一元碱BOH溶液里
H++A-,0.1mol/L某一元碱BOH溶液里![]() ,由于Kw=1×10-14,所以c (OH-)=0.1mol/L,因此BOH是一元强碱。将此两种溶液等体积混合后,二者恰好完全反应产生强碱弱酸盐BA。A.根据物料守恒可知c (B+)= c (A-)+c(HA),所以c (B+)>c (A-),由于A-水解,消耗水电离产生的H+,所以溶液达到平衡时c (OH-)>c (H+),盐水解程度是微弱的,主要以盐电离产生的离子存在,故溶液中离子浓度大小关系是c (B+)>c (A-)>c (OH-) >c (H+),错误;B. 由于HA是弱酸,A-会发生水解反应,所以c (B+)>c (A-),水解消耗H+,所以c (OH-)>c (H+),错误;C.根据质子守恒可知c (OH-) =c (H+)+c(HA) ,所以c (OH-)- c (H+)=c(HA),正确;D.根据电荷守恒可知 c (B+)+ c (H+)=c (A-)+c (OH-) ,错误。
,由于Kw=1×10-14,所以c (OH-)=0.1mol/L,因此BOH是一元强碱。将此两种溶液等体积混合后,二者恰好完全反应产生强碱弱酸盐BA。A.根据物料守恒可知c (B+)= c (A-)+c(HA),所以c (B+)>c (A-),由于A-水解,消耗水电离产生的H+,所以溶液达到平衡时c (OH-)>c (H+),盐水解程度是微弱的,主要以盐电离产生的离子存在,故溶液中离子浓度大小关系是c (B+)>c (A-)>c (OH-) >c (H+),错误;B. 由于HA是弱酸,A-会发生水解反应,所以c (B+)>c (A-),水解消耗H+,所以c (OH-)>c (H+),错误;C.根据质子守恒可知c (OH-) =c (H+)+c(HA) ,所以c (OH-)- c (H+)=c(HA),正确;D.根据电荷守恒可知 c (B+)+ c (H+)=c (A-)+c (OH-) ,错误。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】钛矿工业中的酸性废水富含Ti、Fe等元素,其综合利用如下:

已知:TiO2+易水解,只能存在于强酸性溶液中。
(1)TiO2+钛的化合价为________
(2)步骤I中检验钛矿废水中加入铁屑是否足量的试剂是________。
(3)步骤Ⅲ中发生反应的离子方程式为______________;反应温度一般需控制在35℃以下,其目的是___________________。
(4)已知Ksp[Fe(OH)2] = 8×10-16。步骤Ⅲ中,FeCO3达到溶解平衡时,若室温下测得溶液的pH为8.5,c(Fe2+)=1×10-6 mol/L。试判断所得的FeCO3中____(填“有”或“没有”)Fe(OH)2;步骤Ⅳ中,为了得到较为纯净的Fe2O3,除了适当的温度外,还需要采取的措施是____。
(5)向“富含TiO2+溶液”中加入Na2CO3粉末得到固体TiO2·nH2O。请结合原理和化学用语解释其原因___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列排列顺序不正确的是
A.热稳定性:HF>H2O>NH3B.原子半径:Cl>S>P
C.碱性:NaOH>Mg(OH)2>Al(OH)3D.金属性:K>Na>Li
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不能说明氧的非金属性比硫强的事实是( )
A.H2O的热稳定性强于H2S
B.H2S水溶液暴露于空气中变浑浊
C.常温下H2O是液体,H2S是气体
D.O2和H2化合比S和H2化合容易
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴螨酯是一种杀螨剂。由某种苯的同系物制备溴螨酯的一种合成路线如下( 部分反应条件和试剂略):
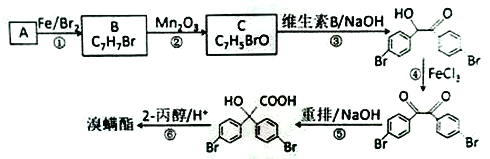
回答下列问题:
(1)A的名称是________,B 的结构简式是_______。
(2)C能发生银镜反应,其分子中含氧官能团的名称是_______。
(3)写出第3 步反应的化学方程式:________。
(4)第①、④步的反应类型分别是_______、_______。
(5)M为 的同分异构体,其核磁共振氢谱显示有4 种不同化学环境的氢,且数目比为4:4:1:1,M的结构简式为____________。
的同分异构体,其核磁共振氢谱显示有4 种不同化学环境的氢,且数目比为4:4:1:1,M的结构简式为____________。
(6)写出用乙醛为原料制备2-羟基-2-甲基丙酸乙酯的合成路线( 其它试剂任选):________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组同学利用下图装置测定FeSO4·xH2O中结晶水含量,实验前测得装置A(包括石英玻璃管及两端开关K1和K2)的质量为m1g装入样品测得装置A的质量为m2g.下列有关说法错误的是

A. 仪器B的名称为球形干燥管,其中可装入碱石灰
B. 加热前先通入一段时间的N2以排除装置中的空气,目的是防止发生爆炸
C. 若加热直至恒重时,A的质量为m3g,则![]()
D. 若先加热一段时间后再通入N2或撤去B装置都会使x值偏低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种漂白、消毒剂,广泛应用于纸浆、棉纺等物质漂白。一种制备NaClO2粗产品的工艺流程如下图所示:

已知:①纯净的ClO2因易分解而发生爆炸。
②NaClO2饱和溶液在低于38℃时析出NaClO2·3H2O晶体;高于38℃时析出
NaClO2晶体;高于60℃时NaClO2分解生成NaClO3和NaCl。
试回答下列问题:
(1)向发生器中鼓入足量空气,其目的是____(选填序号)。
a.将SO2氧化成SO3,以增强酸性
b.稀释CO2气体,以防止发生爆炸
c.将发生器中气体全部吹出,以减少ClO2损失
(2)吸收塔中反应的离子方程式为___
(3)ClO2发生器中反应的化学方程式为___________
(4)从吸收塔中可获得 NaClO2溶液,从NaClO2溶液到NaCO2产品,经过的操作步骤依次为:①______℃下减压蒸发结晶;②________;③洗涤;④低温干燥,得到成品。
(5)“电解”中阳极的电极反应式是_________,阴极反应的主要产物是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.尿素[CO(NH2)2]是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为两步反应:
第一步:2NH3(g)+CO2(g)===H2NCOONH4(s) ΔH=-272kJ·mol-1
第二步:H2NCOONH4(s)===CO(NH2)2(s)+H2O(g) ΔH=+138kJ·mol-1
(1)写出工业上以NH3、CO2为原料合成尿素的热化学方程式:_________________________
(2)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分的物质的量随时间的变化如下图所示:

已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第_________步反应决定,总反应进行到_________min时到达平衡。
(3)电解尿素[CO(NH2)2]的碱性溶液制纯净氢气的过程中同时产生氮气。电解时,阳极的电极反应式为________________________________。
Ⅱ.用焦炭还原NO2的反应为:2NO2(g)+2C(s )![]() N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:

①A、B两点的浓度平衡常数关系:Kc(A)_______Kc(B) (填 “﹥”、“<”或“﹦”)。
②计算C点时该反应的压强平衡常数Kp(C)=______(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com