
| A. | 不能发生氧化反应 | |
| B. | 至少有三种同分异构体可以水解得到甲酸或甲醇 | |
| C. | 至少有三种同分异构体能与NaOH溶液反应 | |
| D. | 分子中含有碳碳双键或碳氧双键 |
分析 有机物的分子式为C3H6O2,该分子的不饱和度=$\frac{3×2+2-6}{2}$=1,该物质结构简式可能为HOCH2CH=CHCH2OH、CH3CH2COOH、HCOOCH2CH3、CH3COOCH3、HOCH2CH2CHO等,根据醇、烯烃、羧酸、酯、醛等物质的性质分析解答.
解答 解:A.有机物的分子式为C3H6O2,该分子的不饱和度=$\frac{3×2+2-6}{2}$=1,该物质结构简式可能为HOCH2CH=CHCH2OH、CH3CH2COOH、HCOOCH2CH3、CH3COOCH3、HOCH2CH2CHO等,如果为醛和醇,能发生氧化反应,故A错误;
B.能水解生成甲醇的有CH3COOCH3,水解生成甲酸的有HCOOCH2CH3,所以只有两种,故B错误;
C.能和NaOH溶液反应的有酯和羧酸,为CH3CH2COOH、HCOOCH2CH3、CH3COOCH3,有3种物质能和NaOH溶液反应,故C错误;
D.有机物的分子式为C3H6O2,该分子的不饱和度=$\frac{3×2+2-6}{2}$=1,所以该分子中一定含有碳碳双键或碳氧双键,故D正确;
故选D.
点评 本题考查有机物结构和性质,为高频考点,侧重考查学生分析判断能力,正确判断该物质结构特点是解本题关键,注意不饱和度的计算方法,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | E | R | F | |||||
| 3 | A | C | D | H | I | G | ||
| 4 | B |
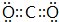 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1(NH4)2Fe(SO4)2溶液:c (SO42-)>c(NH4+)>c(Fe2+)>c(H+) | |
| B. | 常温下pH=2的HCl溶液与pH=12的氨水溶液等体积混合c(NH4+)=c(Cl-) | |
| C. | 0.2 mol•L-1 Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 某二元弱酸的酸式盐NaHA溶液:c(Na+)+c(H+)=c(OH-)+c(HA-)+c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 透明的溶液中:Na+、Cu2+、SO42-、Cl- | |
| B. | pH=1的溶液中:Al3+、Mg2+、S2O32-、AlO2- | |
| C. | 能使酚酞变红色的溶液中:Fe3+、Ba2+、HC2O4-、Cl- | |
| D. | 常温下,水电离的c(OH-)=1×10-12mol•L-1溶液中:NH4+、Fe2+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
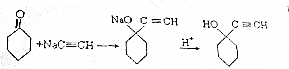
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.50 | 22.60 |
| 第二次 | 20.00 | 1.00 | 24.50 |
| 第三次 | 20.00 | 2.10 | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
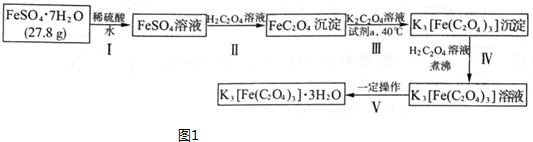
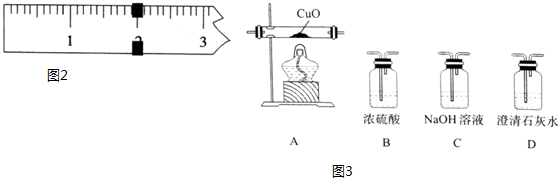
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com