
| A. | $\frac{mY-XY+2m}{m}$ | B. | Y-X+2 | C. | $\frac{mY+XY-2m}{m}$ | D. | Y-X-2 |
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:解答题
| 温度 | 250℃600℃1000℃2000℃ |
| 主要成分 | Fe2O3 Fe3O4 FeO Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑦ | B. | ①④⑥ | C. | ②③⑥ | D. | ①④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NO2=N2O4与N2O4=2NO2 | |
| B. | H2+I2$\frac{\underline{\;\;△\;\;}}{\;}$2HI与2HI$\frac{\underline{\;\;△\;\;}}{\;}$H2+I2 | |
| C. | CO2+H2O=H2CO3与 H2CO3=CO2↑+H2O | |
| D. | CaO+CO2=CaCO3与CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,7.8 gNa2O2含有的Na+数为0.2NA | |
| B. | 标准状况下,22.4 LCl2与水充分反应,转移的电子数为NA | |
| C. | 标准状况下,NA个CO2与SO2的混合气体分子占有的体积约为22.4 L | |
| D. | 50℃、1×105Pa下6g NO2与0℃、2×105 Pa下46 g N2O4均含有3NA个原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
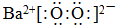 .
.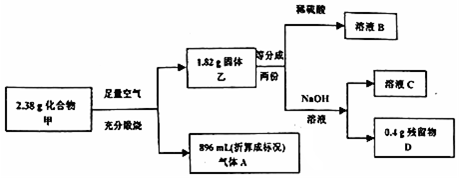
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有机物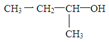 的名称为2-丁醇 的名称为2-丁醇 | |
| B. | 蛋白质、淀粉、纤维素都是高分子化合物 | |
| C. | 合成有机物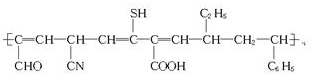 使用的单体有3种 使用的单体有3种 | |
| D. | 等质量的乙烯和乙醇完全燃烧消耗氧气的量相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com