
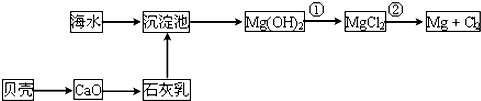
| ||
| ||


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
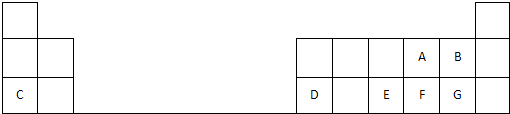
查看答案和解析>>
科目:高中化学 来源: 题型:
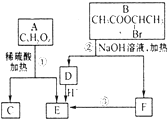 已知当一个碳原子上连有两个羟基时,易发生下列转化:
已知当一个碳原子上连有两个羟基时,易发生下列转化: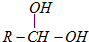
| H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、油脂是多种高级脂肪酸的甘油酯,要合理摄入 |
| B、乙酸乙酯和高级脂肪酸甘油酯都能与氢氧化钠溶液发生反应,都有酸性 |
| C、植物油能使酸性高锰酸钾溶液褪色 |
| D、油脂的水解反应是取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯和苯都能使溴水褪色 |
| B、乙醇和二甲醚(CH3OCH3)互称为同分异构体 |
| C、石油的分馏属于物理变化 |
| D、纤维素、油脂、蛋白质三种高分子化合物均能水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| [OH-] |
| [NH3?H2O] |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com