
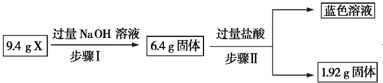
| A. | 根据上述步骤Ⅱ可以得出蓝色溶液中n(Cu2+)=0.02 mol | |
| B. | 步骤Ⅱ中质量减少的固体物质一定是Fe2O3 | |
| C. | 步骤Ⅰ中减少的3 g固体一定是混合物 | |
| D. | 根据步骤Ⅰ、Ⅱ可以判断X中氧化铁的质量分数为50% |
分析 9.4gX与过量的氢氧化钠溶液反应后得到6.4g不溶物,固体部分溶解,原固体中至少含有Al2O3、SiO2中的一种物质;6.4g固体与过量的盐酸反应得到蓝色溶液,蓝色溶液中存在铜离子,发生Fe2O3+6H+═2Fe3++3H2O、Cu+2Fe3+═2Fe2++Cu2+,说明原固体中一定存在Fe2O3,1.92g固体为铜,以此来解答.
解答 解:A.6.4g变成1.92g,质量减少6.4g-1.92g=4.48g,减少的质量为Fe2O3和部分Cu,剩余的1.92g为铜,设溶解的铜的物质的量为x,根据反应Cu+2Fe3+═2Fe2++Cu2+可知氧化铁的物质的量也为x,则64x+160x=4.48,解得x=0.02mol,故A正确;
B.步骤II中发生了反应:Fe2O3+6H+═2Fe3++3H2O、Cu+2Fe3+═2Fe2++Cu2+,6.4g固体为铜和Fe2O3的混合物,减少的为铜和氧化铁,故B错误;
C.Al2O3、SiO2都能够与NaOH溶液反应,所以步骤I中减少的3g固体可能为氧化铝或二氧化硅,不一定为混合物,故C错误;
D.6.4g变成1.92g,质量减少6.4g-1.92g=4.48g,减少的质量为Fe2O3和部分Cu,剩余的1.92g为铜,设铜的物质的量为x,根据反应Cu+2Fe3+═2Fe2++Cu2+可知氧化铁的物质的量也为x,则64x+160x=4.48,解得x=0.02mol,则m(Fe2O3):m(Cu)=(160×0.02):(64×0.02+1.92)=1:1,混合物X中还含Al2O3、SiO2中的一种物质或两种,则X中氧化铁的质量分数小于50%,故D错误;
故选A.
点评 本题考查物质成分的确定,为高频考点,把握流程及反应为解答的关键,侧重分析、推断及计算能力的综合考查,注意合理分析题中数据,根据题中数据及反应方程式计算出铜和氧化铁的质量,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
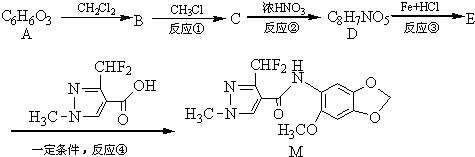
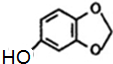 ;A的名称(系统命名)是1,2,4-苯三酚.
;A的名称(系统命名)是1,2,4-苯三酚.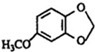 +HNO3(浓)$\stackrel{0℃-5℃}{→}$
+HNO3(浓)$\stackrel{0℃-5℃}{→}$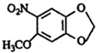 +H2O;反应①和②的先后次序不能颠倒,其原因是B中有酚羟基,若硝化,会被硝酸氧化而降低M的产率.
+H2O;反应①和②的先后次序不能颠倒,其原因是B中有酚羟基,若硝化,会被硝酸氧化而降低M的产率.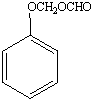 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每消耗1molCH4可以向外电路转移4mol电子 | |
| B. | 负极上CH4失去电子,电极反应式为CH4+10OH--8e-═CO32-+7H2O | |
| C. | 负极上是O2获得电子,电极反应式为:O2+2H2O+4e-═4OH- | |
| D. | 电池放电后,溶液pH不断升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +30.67 | B. | -345.3 | C. | -30.67 | D. | +345.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,3.0g含甲醛的冰醋酸中含有的原子总数为0.4 NA | |
| B. | 标准状况下,2.24L苯中含有的C-H键的数目为0.6NA | |
| C. | 1 L 0.01 mol•L-1 KAl(SO4)2溶液中,含有的阳离子数目为0.02NA | |
| D. | 反应KIO3+6HI=3I2+KI+3H2O,每生成1.5mol I2转移电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y、Z、W三种元素组成化合物的水溶液可能显碱性 | |
| B. | Z与Y、Z与W形成的化合物的化学键类型完全相同 | |
| C. | 简单离子的半径:Z>R>W>Y | |
| D. | 因非金属性Y>R,所以X与Y组成化合物的沸点低于X与R组成的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解过程产生的气体体积(在标准状况下)为5.6 L | |
| B. | 电解过程只发生了2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4 | |
| C. | 电解过程转移的电子数为3.612×1023个 | |
| D. | 加入的碱式碳酸铜的反应是:Cu2(OH)2CO3+2H2SO4═2CuSO4+CO2↑+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
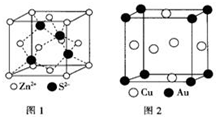 1967年舒尔滋提出金属互化物的概念,其定义为固相金属间化合物拥有两种或两种以上的金属元素,如Cu9Al4、Cu5Zn8 等.回答下列问题:
1967年舒尔滋提出金属互化物的概念,其定义为固相金属间化合物拥有两种或两种以上的金属元素,如Cu9Al4、Cu5Zn8 等.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化镁属于电解质,工业上可用电解其溶液的方法制镁 | |
| B. | 钠钾合金的硬度小,可用作快中子反应堆的热交换剂 | |
| C. | Fe2O3是红棕色固体,可以制成红色的油漆、涂料 | |
| D. | 溴单质在CCl4中的溶解度大,可用CCl4萃取Br- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com