
【题目】设NA 表示阿伏加德罗常数的值,下列叙述中正确的是
A.3g甲醛所含碳原子数为0.2NA
B.1mol CH3OH分子含有的电子总数为18NA
C.44gC3H8中含有共价键的数目为11NA
D.17g羟基中含有的电子数为10NA
科目:高中化学 来源: 题型:
【题目】额度图有机物分子中带“*”碳原子是手性碳原子。该有机物分别发生下列反应,生成的有机物分子中不会含有手性碳原子的是
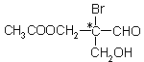
①与甲酸发生酯化反应
②与足量NaOH水溶液反应
③与银氨溶液作用只发生银镜反应
④催化剂作用下与H2反应
A、①②③④ B、①③ C、②④ D、以上反应都不成立
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或方法能达到目的的是
A.用氨水除去试管内壁上的银镜
B.用分液的方法分离乙酸乙酯和乙醇的混合物
C.用点燃的方法鉴别乙醇、苯和四氯化碳
D.用溴水鉴别苯、甲苯和乙苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关氨的实验室制取和性质实验如下:

(1)实验室制取氨气的化学方程式为____。
(2)如图是实验室进行氨气溶于水的喷泉实验装置,下列叙述错误的是____。
A.该实验说明氨气是一种极易溶于水的气体
B.进入烧瓶中的液体颜色由无色变为红色,说明氨水呈碱性
C.形成喷泉的原因是氨气溶于水后,烧瓶内的气压小于大气压
D.用氯气代替氨气,利用此装置也可进行喷泉实验
(3)干燥的氨气在高温下能被氧化铜氧化,生成两种单质和一种化合物。反应的化学方程式是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,利用培养皿探究SO2的性质。实验时向Na2SO3固体上滴几滴浓硫酸,立即用一玻片盖在培养皿上。下表中对实验现象的描述或所作的解释错误的是( )

选项 | 实验现象 | 解 释 |
A | BaCl2溶液变浑浊 | SO2与BaCl2溶液反应产生了BaSO3沉淀 |
B | Na2S溶液变浑浊 | SO2与Na2S溶液反应产生了硫单质 |
C | KMnO4溶液褪色 | SO2具有还原性 |
D | 品红溶液褪色 | SO2具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源危机当前是一个全球性问题,开源节流是应对能源危机的重要举措。
(1)下列做法有助于“开源节流”的是________(填序号)。
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气,以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热能等新能源,减少使用煤、石油等化石燃料
d.减少资源消耗,注重资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示。
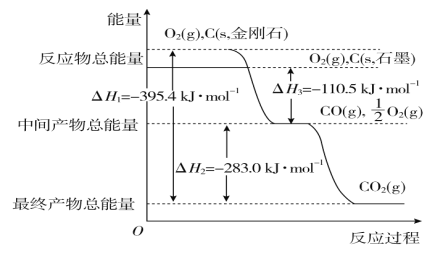
①在通常状况下,金刚石和石墨相比较,________(填“金刚石”或“石墨”)更稳定,石墨的燃烧热为________。
②12 g石墨在一定量的空气中燃烧,生成气体36 g,该过程放出的热量为________。
(3)已知:N2、O2分子中化学键的键能分别是946 kJ·mol-1、497 kJ·mol-1。
N2(g)+O2(g)===2NO(g) ΔH=+180.0 kJ· mol-1NO分子中化学键的键能为____kJ·mol-1。
(4)综合上述有关信息,请写出用CO除去NO的热化学方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某市对大气进行检测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5um的悬浮颗粒物)其主要来源为燃烧、机动车尾气等。因此,对PM2.5、SO2、NO等进行研究具有重要意义。回答下列问题:
(1)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l) H=-890.3KJ/mol
②N2(g)+O2(g)=2NO(g) H=+180KJ/mol
CH4可用于燃烧脱硝,CH4(g)+4NO(g)=CO2(g)+2N2(g)+2H2O(l) H=_______________。
(2)汽车尾气中NOx和CO的生成及转化
①已知气缸中生成NO的反应为:N2(g)+O2(g) ![]() 2NO(g) H>0。汽车启动后,气缸温度较高,单位时间内NO排放量越大,原因是_______________________。
2NO(g) H>0。汽车启动后,气缸温度较高,单位时间内NO排放量越大,原因是_______________________。
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO;2CO(g)=2C(s)+O2(g)已知反应的H>0,简述该设想能否实现的依据_______________________。
③目前,在汽车尾气系统中安装催化转化器可减少CO和NO的污染,其化学方程式为_______________。
(3)一定温度下,在密闭容器中反应2NO2(g) ![]() N2O4(g) H=-57.20KJ/mol达到平衡。其他条件不变时,下列措施能提高NO2转化率的是____________(填字母)
N2O4(g) H=-57.20KJ/mol达到平衡。其他条件不变时,下列措施能提高NO2转化率的是____________(填字母)
A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
在一定温度和压强下,密闭容器中N2O4和NO2的混合气体达到平衡时,c(N2O4)=0.0120mol/L(已知2NO2(g) ![]() N2O4(g)反应在该温度下的平衡常数K=40/3)。计算平衡时 NO2物质的量浓度为________________。
N2O4(g)反应在该温度下的平衡常数K=40/3)。计算平衡时 NO2物质的量浓度为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯醇(CH2=CH—CH2OH)可发生的化学反应有( )
①加成 ②氧化 ③酯化 ④加聚 ⑤取代
A.只有①②③ B.只有①②③④ C.①②③④⑤ D.只有①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲酸香叶酯是一种食品香料,可由香叶醇与甲酸发生酯化反应制得。
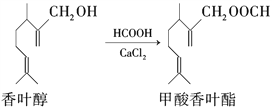
下列说法中正确的是( )
A. 香叶醇的分子式为C11H18O
B. 香叶醇在浓硫酸、加热条件下可发生消去反应
C. 1mol甲酸香叶酯可以与2molH2发生加成反应
D. 甲酸香叶酯分子中所有碳原子均可能共平面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com