
| A. | Na | B. | Mg | C. | Cl | D. | Ne |
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、CO32-、Cu2+、SO42- | B. | K+、Fe3+、SO42-、OH- | ||
| C. | Ca2+、NO3-、Cl-、K+ | D. | Ba2+、K+、MnO4-、NO3- |
查看答案和解析>>
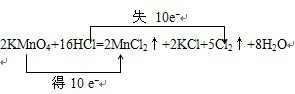
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
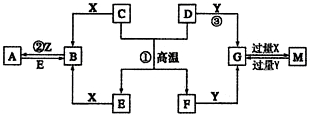
科目:高中化学 来源: 题型:解答题
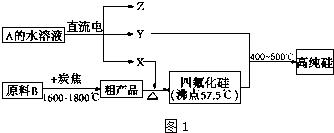
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热会使蛋白质变性,因此生吃鸡蛋比熟吃好 | |
| B. | 蛋白质水解时直接变成氨基酸 | |
| C. | 一束光线照射蛋白质溶液,产生丁达尔效应 | |
| D. | 蛋白质仅含C、H、O、N四种元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2、H2完全转化为NH3 | B. | N2、H2、NH3的浓度一定相等 | ||
| C. | 正、逆反应速率相等且等于零 | D. | N2、H2、NH3的浓度不再改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将水加热,KW增大,pH不变 | |
| B. | 向水中加入少量NaHSO4固体,恢复到原温度,水的电离被抑制,C(H+) 增大 | |
| C. | 向水中加入少量NH4Cl固体,恢复到原温度,水的电离程度减小 | |
| D. | 向水中加少量KOH固体,恢复到原温度,水的电离程度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的摩尔质量为28 | |
| B. | 标准状况下,11.2 L四氯化碳所含分子数为0.5 NA | |
| C. | 1L 0.1mol/L Na2CO3溶液中含CO32-数目为0.1NA | |
| D. | 16g CH4所含电子数目为10NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com