
| A、①②③④ | B、③④①② |
| C、④③①② | D、②①④③ |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
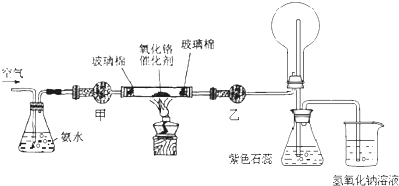
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①>②>③>④ |
| B、③=①>②>④ |
| C、③>②>④>① |
| D、②>③=①>④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A的百分含量不再改变 |
| B、各组分的浓度不再改变 |
| C、反应速率υA:υB:υC:υD=m:n:p:q |
| D、单位时间内m mol A断键发生反应,同时p mol C也断键发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
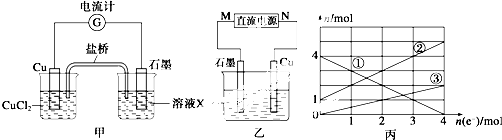
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增加甲烷的量,△H增大 |
| B、增加水蒸气的量,可提高甲烷的转化率 |
| C、升高温度,逆反应速率增大 |
| D、增大体系压强,该反应的化学平衡常数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCl和NaOH反应的中和热△H=-57.3 kJ?mol-1,则H2SO4和Ba(OH)2反应的中和热△H=-114.6kJ?mol-1 |
| B、CO(g)的燃烧热是283.0 kJ?mol-1,则2CO2(g)=2CO(g)+O2(g)反应的△H=+566.0 kJ?mol-1 |
| C、需要加热才能发生的反应一定是吸热反应 |
| D、若将等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硫酸和稀NaOH溶液反应,生成 l mol水时放热57.3 kJ |
| B、含l molH2SO4的稀硫酸与足量稀NaOH溶液中和后,放热为57.3 kJ |
| C、1L 0.l mol/L CH3COOH与1L 0.l1 mol/L NaOH溶液反应后放热为5.73 kJ |
| D、1L 0.l mol/L HNO3与1L 0.l1 mol/L NaOH溶液反应后放热为5.73 kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com