
| A. | x=10时,溶液中有NH4+、Al3+、SO42-,且c(NH4+)=c(SO42-)>c(Al3+) | |
| B. | x=15时,溶液中有NH4+、SO42-,且c(NH4+)<2c(SO42-) | |
| C. | x=20时,溶液中有NH4+、Al3+、OH-,且c(OH-)<c(Al3+) | |
| D. | x=30时,溶液中有Ba2+、AlO2-、OH-,且c(OH-)=c(Ba2+) |
分析 10mL 0.1mol•L-1硫酸铝铵[NH4Al(SO4)2],NH4Al(SO4)2物质的量为0.001mol.溶液含有NH4+0.001mol、Al3+0.001mol、SO42-0.002mol;
x=10时,同时发生反应为:SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al(OH)3↓,当Al3+沉淀完全时需加入0.003molOH-,即加入0.0015molBa(OH)2;
x=15时,加入的Ba2+为0.0015mol,Al3+沉淀完全,SO42-未完全沉淀,此时溶液含有硫酸铵;
x=20时,发生反应为:SO42-+Ba2+=BaSO4↓、NH4++OH-=NH3?H2O,SO42-完全沉淀,生成Al(OH)30.001mol,剩余0.001molOH-恰好与NH4+完全反应,此时溶液中NH4+完全反应,此时溶液为氨水溶液;
x=30时,溶液中的溶质为氢氧化钡、一水合氨,以此来解答.
解答 解:A.当x=10时,10ml0.1mol/LNH4Al(SO4)2溶液中含有0.001molNH4+,0.001molAl3+,0.002molSO42-,同时发生反应为SO42-+Ba2+=BaSO4↓、Al3++3OH-=Al(OH)3↓,c( NH4+)>c(Al3+),故A正确;
B.x=15时,加入的Ba2+为0.0015mol,Al3+沉淀完全,SO42-未完全沉淀,此时溶液含有硫酸铵,含有0.001molNH4+,0.0005molSO42-,且铵根离子水解,则c(NH4+)<2c(SO42-),故B正确;
C.x=20时,发生反应为:SO42-+Ba2+=BaSO4↓、NH4++OH-=NH3?H2O,SO42-完全沉淀,生成Al(OH)30.001mol,剩余0.001molOH-恰好与NH4+完全反应,此时溶液中NH4+完全反应,此时溶液为氨水溶液,故C错误;
D.当x=30时,10ml0.1mol/LNH4Al(SO4)2溶液中含有0.001molNH4+,0.001molAl3+,0.002molSO42-,30ml等浓度Ba(OH)2溶液有0.003molBa2+,6mmolOH-,混合后硫酸钡沉淀,剩余0.001molBa2+,OH-过量溶液中存在0.001moAlO2-,铵根离子和氢氧根离子反应生成一水合氨,氢氧根离子剩余0.001mol,一水合氨电离生成铵根离子和氢氧根离子,此时c(OH-)>(Ba2+),故D错误;
故选AB.
点评 本题考查离子反应的有关混合计算及离子浓度大小的比较,为高频考点,根据发生的反应及反应先后顺序、各物质的物质的量关系是解答的关键,侧重分析与计算能力的考查,题目难度中等.


 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | H2O2是中间产物,不是催化剂 | |
| B. | 总反应速率由反应(1)决定 | |
| C. | 用不同物质表示的反应速率,数值和含义都相同 | |
| D. | 加入高效催化剂,能降低反应的活化能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
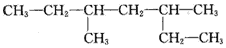
| A. | 该有机物属于烷烃 | |
| B. | 该烃的名称是3,5-二甲基庚烷 | |
| C. | 该烃与2-甲基-3-乙基己烷互为同分异构体 | |
| D. | 它的最简单的同系物二氯代物有两种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一个D2O分子所含的中子数为8 | B. | CO2的电子式::O::C::O: | ||
| C. | 水的结构简式:H-O-H | D. | HCl的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
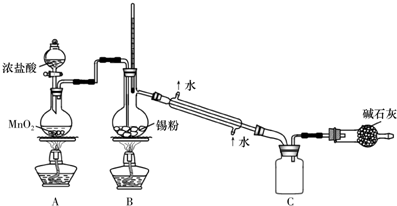
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
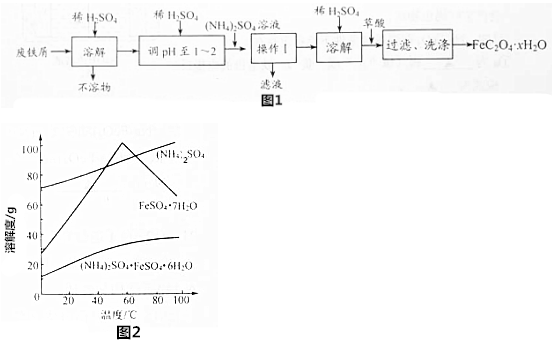
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
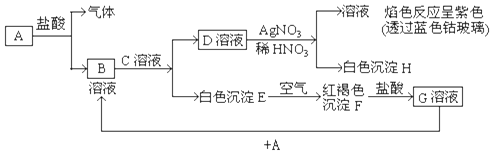
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com