
ijС��ȡһ��������FeSO4���壬������ͼװ�ý���ʵ�顣250mL����ƿ
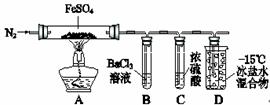
| ʵ����� | ʵ������ | |
| �� | ͨ��һ��ʱ��N2������ | A�й����Ϊ����ɫ��B���а�ɫ������D�Թ�������ɫҺ�� |
| �� | �ô��л��ǵ�ľ������װ��D�ĵ��ܿ� | ľ����ȼ |
| �� | ��ַ�Ӧ��ֹͣ���ȣ���ȴ��ȡA�й��壬������ | �����ܽ⣬��Һ�ʻ�ɫ |
| �� | ����������Һ����D�Թ��� | ��Һ��Ϊdz��ɫ |
��֪��SO2�۵�C72�棬�е�C10�棻SO3�۵�16.8�棬�е�44.8�档
��1��ʵ��۷�Ӧ�����ӷ���ʽ�� ��
��2���ֽ���̳�����ʹľ����ȼ�������⣬����A�й�����ɫ�仯�Ʋ⣬��һ����______���壬������ ��
��3��ʵ��ܷ�Ӧ�����ӷ���ʽ��__ _____��
��4��ijͬѧ����B�е�������ΪFeSO4�ֽ�һ����SO3���ɡ�����Ϊ�Ƿ���ȷ��ԭ���ǣ��ñ�Ҫ�����ֺͻ�ѧ����ʽ���ͣ�___ __ �����ȷ������ȷ��������
��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��״���£�6.72 L NO2ͨ��ˮ���ռ���5.04 L���壬��������NO2�������(����)
A��1.68 L B��2.52 L C��0.56 L D��1.12 L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��1��ij����С���о��ں��¡����ݣ������ݻ�Ϊ2L)�·�Ӧ��N2(g)��3H2(g)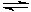 2NH3(g)�ı仯����ʼ����n(H2)��3mol��n(N2)��1mol����Ӧ�ﵽƽ��ʱH2��ת����Ϊ60%��NH3���������Ϊa%��
2NH3(g)�ı仯����ʼ����n(H2)��3mol��n(N2)��1mol����Ӧ�ﵽƽ��ʱH2��ת����Ϊ60%��NH3���������Ϊa%��
�ٴ������·�Ӧ��ƽ�ⳣ��K��
������ʼ����Ϊn(H2)��n(N2)��0mol��n(NH3)��2.0mol����Ӧ�ﵽƽ��ʱNH3��ת����Ϊ
������ʼ����Ϊn(H2)��6mol��n(N2)��2mol����Ӧ�ﵽƽ��ʱNH3��������� a%�������������������������
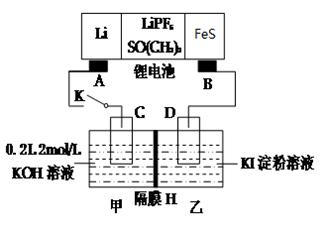
��2��﮵�ع㷺ʹ�����ֱ���������ȵ��Ӳ�Ʒ�У������ȶ��Ժá���㡢�������ŵ㡣��ͼ����﮵��Ϊ��Դ�ĵ��ۡ�
��LiPF6��Ϊ��صĵ���ʣ��ɴ���Li+���磬��֪��ط�ӦΪFeS��2Li��Fe��Li2S��AΪ﮵�ص� ������﮵�ص�������ӦΪ ��
�ڸ�ĤHΪ�����ӽ���Ĥ�������������в����������ڱ�״���µ����Ϊ4.48L�����ĤH��ͨ����������ĿΪ ��������Һ��Ũ��Ϊ ��������Һ������䣩��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����һ������Cu��Fe2O3��ɵĻ���ƽ���ֳ����ȷ֣�������һ�ݼ���2 mol��L-1��������Һ150 mL��ǡ����ȫ�ܽ⣬������Һ����KSCN��Ѫ��ɫ���֡����ù�����CO�ڸ����»�ԭԭ����������������Ϊ�� ��
A. 1.6 g B. 2.4 g C. 3.2 g D. 4.8 g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�ֽ�35gп��������Ũ�����ڼ��������³�ַ�Ӧ�����ռ����������11.2L����״������������Ϊ19.6g�����ʣ��п�۵�����Ϊ��������
A��1.0g B��2.0g C��2.5g D��3.5g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��Ӧ3A(g)+B(g) 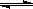 2C(g)+2D(g)���ڲ�ͬ����²�÷�Ӧ�������£����з�Ӧ����������
2C(g)+2D(g)���ڲ�ͬ����²�÷�Ӧ�������£����з�Ӧ����������
A��v (A)=0.15 mol��L-1��s-1 B��v (B)=0.3 mol��L-1��s-1
C��v (C)=0.5 mol��L-1��s-1 D��v (D)=0.4 mol��L-1��s-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
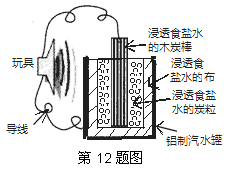 ��ͼ��һ���÷Ͼɲ��������Ŀ�����������ߵĵ��ʾ��ͼ���õ�ع���ʱ���й�˵����ȷ����
��ͼ��һ���÷Ͼɲ��������Ŀ�����������ߵĵ��ʾ��ͼ���õ�ع���ʱ���й�˵����ȷ����
A��ľ̿��Ӧ����ߵ���ĸ�������
B��̿����̿���Ϸ����ĵ缫��Ӧ�ǣ�O2+4e-=2O2-
C����������ʴ
D����Ϊһ��ʼ��Ӧ�ͻ����ɴ����������õ����һ��
������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����˵����ȷ����
A��HNO3��Ħ������Ϊ63
B��Ħ�������ʵ����ĵ�λ
C��1 mol�κ����ʶ�Լ����6.02��1023��ԭ��
D��64 g SO2���1mol O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
25��ʱ��ˮ�ĵ���ɴﵽƽ�⣺H2O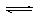 H++OH- ��H��0������������ȷ�ģ� ��
H++OH- ��H��0������������ȷ�ģ� ��
A. ��ˮ�м���NaOH���壬ƽ�������ƶ���c(OH-)����
B. ��ˮ���ȣ�Kw����c(OH��)����
C. ��ˮ�м�������CH3COONa���壬ƽ�������ƶ���
D. ��ˮ�м�������ϡ���ᣬc(H+)����Kw����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com