
| 气体总浓度(mol/L) 温度(℃) 时间(min) |
15 | 25 | 35 |
| 0 | 0 | 0 | 0 |
| t1 | 0.9×10-3 | 2.7×10-3 | 8.1×10-3 |
| t2 | 2.4×10-3 | 4.8×10-3 | 9.4×10-3 |
| t3 | 2.4×10-3 | 4.8×10-3 | 9.4×10-3 |
| △c |
| t |
| 2 |
| 3 |
| △c |
| t |
| 1.8×10-3 |
| t1 |
| 1.8×10-3 |
| t1 |
| 2 |
| 3 |
| 1 |
| 3 |
| 1 |
| K |
| 1 |
| 2.048×10-9 |


科目:高中化学 来源: 题型:
| 实 验 内 容 | 实 验 目 的 | |
| A | 将SO2通入酸性KMnO4溶液中 | 证明SO2的水溶液具有弱酸性 |
| B | 将饱和的FeCl3溶液滴到沸水中 | 促进Fe3+水解,制得Fe(OH)3胶体 |
| C | 在淀粉KI溶液中滴加少量市售食盐配制的溶液 | 真假碘盐的鉴别 |
| D | 在少量Fe(NO3)2试样加水溶解的溶液中,滴加稀H2SO4酸化,再滴加KSCN溶液 | 检验Fe(NO3)2试样是否变质 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,饱和BaCO3溶液和饱和BaSO4溶液相比,前者的c(Ba2+)大 |
| B、25℃时,若向BaCO3的悬浊液中加入少量的NH4Cl固体,则c(Ba2+)增大 |
| C、25℃时,若将BaSO4与饱和Na2CO3溶液充分混合,则BaSO4与Na2CO3不能反应 |
| D、25℃时,BaCO3在10 mL 0.1 mol?L-1氨水中的Ksp比在10 mL 0.1 mol?L-1NH4Cl溶液中的Ksp小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
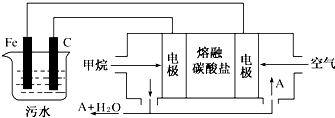
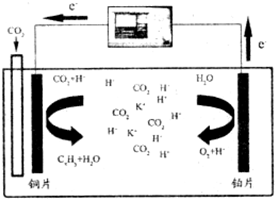
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 氢气是重要而洁净的能源,要利用氢气作能源,必须安全有效地储存氢气.
氢气是重要而洁净的能源,要利用氢气作能源,必须安全有效地储存氢气.| 微粒 | a | b | c | d | e | f | g |
| 原子核数 | 双核 | 双核 | 三核 | 四核 | 四核 | 五核 | 五核 |
| 所带单位电荷 | 0 | -1 | 0 | 0 | +1 | 0 | +1 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
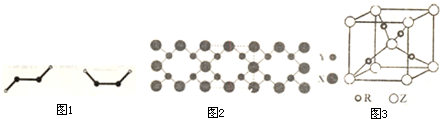
查看答案和解析>>
科目:高中化学 来源: 题型:
 右图为摇摆电池(Rockingchair battery)的工作原理图,在充放电过程中,Li+在两极之间“摇来摇去”,其总反应为:LiCoO2+6C
右图为摇摆电池(Rockingchair battery)的工作原理图,在充放电过程中,Li+在两极之间“摇来摇去”,其总反应为:LiCoO2+6C| 充电 |
| 放电 |
| A、放电时,负极反应LiCoO2-xe-═Li(1-x)CoO2+xLi+ |
| B、充电时,A极发生氧化反应 |
| C、充电时,Li+穿过隔离膜向B极移动 |
| D、当B极失去Xmol电子,电池消耗6 mol C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com