
 ��1����һ���¶��£���2molA��2molB�����������Ϻ����ݻ�Ϊ2L��ij�ܱ������У��������·�Ӧ3A��g��+B��g��?xC��g��+2D��g����2minĩ��Ӧ�ﵽƽ��״̬��������0.8molD�������C��Ũ��Ϊ0.4mol/L������д���пհף�
��1����һ���¶��£���2molA��2molB�����������Ϻ����ݻ�Ϊ2L��ij�ܱ������У��������·�Ӧ3A��g��+B��g��?xC��g��+2D��g����2minĩ��Ӧ�ﵽƽ��״̬��������0.8molD�������C��Ũ��Ϊ0.4mol/L������д���пհף����� ��1����һ���¶��£���2molA��2molB�����������Ϻ����ݻ�Ϊ2L��ij�ܱ������У�2minĩ��Ӧ�ﵽƽ��״̬��������0.8molD�������C��Ũ��Ϊ0.4mol/L������CΪ0.4mol/L��2=0.8mol����
3A��g��+B��g��?xC��g��+2D��g��
��ʼ����mol����2 2 0 0
�仯����mol����1.2 0.8 0.8 0.8
ƽ������mol����0.8 1.2 0.8 0.8
��ƽ��ʱC��Ũ��Ϊ0.4mol/L����n��C��=0.4mol/L��2L=0.8mol�����n��D���������ʵ���֮�ȵ��ڻ�ѧ������֮�ȼ���x��
�ڸ���ƽ��ʱn��D�����ɷ���ʽ��֪�μӷ�Ӧ��n��A��=$\frac{3}{2}$n��D�����ٸ���ת���ʶ������A��ת���ʣ�
�����ݷ�Ӧ���ʸ������v=$\frac{��c}{��t}$��
�ܷ�Ӧǰ������������䣬����ѹǿƽ�ⲻ����
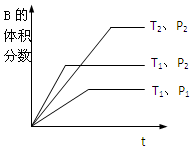
��2�����ݡ��ȹ���ƽ����ֵ��ԭ��ȡ��һ����õ��¶Ⱥ�ѹǿ�Ĵ�С��ϵ������ͼʾ�����ѹǿ��B�ĺ����Ĺ�ϵ�жϷ���ʽǰ���ϵ���ʹ�С��ϵ�������¶Ⱥ�B�ĺ����Ĺ�ϵ��ȷ����ѧ��Ӧ�������������
��3������ƽ���ƶ�ԭ���������ı�Ӱ��ƽ���һ����������Ũ�ȡ�ѹǿ���¶ȵȣ���ƽ������ܹ��������ָı�ķ����ƶ���
�ټ�������KSCN���壬��Ӧ��SCN-Ũ������
�ڸ���ʵ�ʲμӷ�Ӧ������Ũ�ȷ�������������KCl���壬��Һ��Fe3+��SCN-Ũ�Ȳ��䣮
��� �⣺��1����һ���¶��£���2molA��2molB�����������Ϻ����ݻ�Ϊ2L��ij�ܱ������У�2minĩ��Ӧ�ﵽƽ��״̬��������0.8molD�������C��Ũ��Ϊ0.4mol/L������CΪ0.4mol/L��2=0.8mol����
3A��g��+B��g��?xC��g��+2D��g��
��ʼ����mol����2 2 0 0
�仯����mol����1.2 0.8 0.8 0.8
ƽ������mol����0.8 1.2 0.8 0.8
��ƽ��ʱC��Ũ��Ϊ0.4mol/L����n��C��=0.4mol/L��2L=0.8mol�����ʵ���֮�ȵ��ڻ�ѧ������֮�ȣ�����0.8mol��0.8mol=x��2�����x=2��
�ʴ�Ϊ��2��
��ƽ��ʱn��D��=0.8mol���ɷ���ʽ��֪�μӷ�Ӧ��n��A��=$\frac{3}{2}$n��D��=$\frac{3}{2}$��0.8mol=1.2mol����A��ת����Ϊ$\frac{1.2mol}{2mol}$��100%=60%��
�ʴ�Ϊ��60%��
������D�ķ�Ӧ����=$\frac{\frac{0.8mol}{2L}}{2min}$=0.2mol/L•min��
�ʴ�Ϊ��0.2mol/L•min��
�ܷ�Ӧǰ����������ʵ������䣬����ѹǿ��ƽ�ⲻ�ƶ���ƽ����ϵ��C�������������䣬
�ʴ�Ϊ�����䣻
��2����ѹǿ��ͬ���Ƚ��¶Ȳ�ͬʱ�����Ƚ�����T1��P2������T2��P2�������ȳ��ֹյ㣬�ȵ���ƽ�⣬�ȳ��ֹյ�����߱�ʾ���¶ȸߣ�����T1��T2�����¶���ͬ���Ƚ�ѹǿ��ͬʱ�����Ƚ�����T1��P1������T1��P2�������ȳ��ֹյ㣬�ȵ���ƽ�⣬�ȳ��ֹյ�����߱�ʾ��ѹǿ�ߣ�����P1��P2��
��ѹǿP1��P2����ͼ֪ѹǿԽ��B�ĺ���Խ�ߣ�����ƽ�����淴Ӧ���У�����ѹǿ��ƽ���������С�ķ����ƶ�������m+n��q���ʴ�Ϊ������
���¶�T1��T2����ͼ֪�¶�Խ�ߣ�B�ĺ���Խ�ͣ�����ƽ��������Ӧ���У������¶ȣ�ƽ�������ȷ����ƶ���������ӦΪ���ȷ�Ӧ���ʴ�Ϊ�����ȣ�
��3���ټ�������KSCN���壬��Ӧ��SCN-Ũ������ƽ���������ƶ���
�ʴ�Ϊ������
�ڼ�������KCl���壬��Һ��Fe3+��SCN-Ũ�Ȳ��䣬K+��Cl-���μӷ�Ӧ��ƽ�ⲻ�ƶ���
�ʴ�Ϊ������
���� ���⿼����������Ի�ѧ��Ӧ���ʡ���ѧƽ���ƶ�Ӱ�졢ѧ��ʶͼ��������Ŀ�ѶȲ�������ʱע�����ͼ�����ߵı仯�ص㣬���ݡ��ȹ���ƽ����ֵ��ԭ��ȡ��һ������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ݢ� | B�� | �ڢۢ� | C�� | �٢ڢݢ� | D�� | �ۢܢݢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1 mol CO2 ������Ϊ44g/mol | |
| B�� | NA��CO2��������CO2����Է���������ֵ����ͬ | |
| C�� | CO2��Ħ����������CO2����Է������� | |
| D�� | CO2��Ħ������Ϊ44g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���⻯��ķе㣺Z��W | |
| B�� | ��W��Y����Ԫ���γɵĻ�����һ���������ۼ� | |
| C�� | ����̬�⻯������ȶ��ԣ�X��W | |
| D�� | Ԫ��Y��Z�ļ����Ӿ�����ͬ�ĵ��Ӳ�ṹ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ͭ���ҹ�ʹ������ĺϽ� | |
| B�� | ���ά��ͨѶ�����������ŵ㣬���¸�ʴ������Ҳ�ܲ����� | |
| C�� | ���½ṹ�մɱȽ������Ͼ��������ŵ㣬�粻���������ܶ�С���ŵ� | |
| D�� | ���ά������ͨѶ�⣬����������ҽ�ơ���Ϣ����������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | v��B2��=0.9mol/��L•s�� | B�� | v��A2��=1.5mol/��L•s�� | ||
| C�� | v��C��=0.62mol/��L•s�� | D�� | v��B2��=90.0mol/��L•min�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com