
| 物 质 | CH4 | CO2 | CO | H2 |
| 平衡浓度(mol?L-1) | 0.5 | 1.0 | 1.0 | 1.0 |
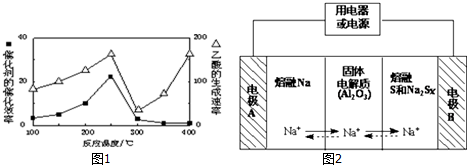
| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
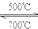 Li2CO3+Li2SiO3;
Li2CO3+Li2SiO3; | 1-0.5 |
| 1 |
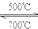 Li2CO3+Li2SiO3,故答案为:CO2+Li4SiO4
Li2CO3+Li2SiO3,故答案为:CO2+Li4SiO4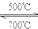 Li2CO3+Li2SiO3;
Li2CO3+Li2SiO3; 

科目:高中化学 来源: 题型:
| A、H++OH-═H2O |
| B、CO32-+2H+═H2O+CO2↑ |
| C、Zn(OH)2+2H+═Zn2++2H2O |
| D、Cu2++2OH-+Ba2++SO42-═BaSO4↓+Cu(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学键 | C-H | C-Cl | H-Cl | Cl-Cl |
| 键能/(kJ/mol) | 414 | 409 | 432 | 243 |
| A、吸热736 kJ |
| B、放热736 kJ |
| C、吸热184kJ |
| D、放热184 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)=c(HS-)+c(S2-)+(H2S) |
| B、c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) |
| C、c(Na+)>c(S2-)>c(OH-)>c(HS-) |
| D、c(OH-)=c(HS-)+c(H+)+c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲烷与丁烯 |
| B、甲烷与丙烯 |
| C、丙烷与乙烯 |
| D、乙烷与丙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
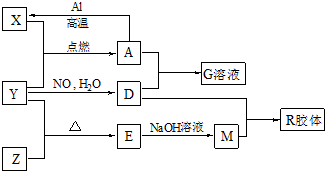
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、增加Fe2O3的量 |
| B、保持容器体积不变,增加H2输入量 |
| C、减少Fe的量 |
| D、保持容器体积不变,增加H2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲的分子数比乙的分子数多 |
| B、甲的物质的量比乙的物质的量小 |
| C、甲的摩尔体积比乙的摩尔体积小 |
| D、甲的相对分子质量比乙的相对分子质量大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com