
将3.6 g铁铜混合粉末,投入100 mL c mol·L-1的稀硝酸中,金属粉末与硝酸恰好完全反应(还原产物只有NO),向反应后的溶液中加入足量的NaOH溶液,充分反应后将沉淀过滤、洗涤、灼烧至恒重后称量为4.8 g。则c值不可能为( )
A.1.2 B.1.75 C.2.3 D.1.95
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
有关化学键和晶体的说法中正确的是( )
A.离子键的本质是静电作用,阴阳离子电荷越大、离子半径越小,静电作用越强
B.共价键的本质是共用电子对,因此必须由成键的两原子各提供一个电子形成
C.分子晶体的基本微粒是分子,分子晶体溶沸点由分子内部共价键强弱决定
D.原子晶体由于是空间网状结构,因此只能由碳、硅两元素构成
查看答案和解析>>
科目:高中化学 来源: 题型:
现有部分短周期主族元素的性质或原子结构如下表所示:
| 元素编号 | 元素性质或原子结构 |
| X | 周期序数=主族序数=原子序数 |
| Y | 原子最外层电子数为a,次外层电子数为b |
| Z | 原子L层电子数为a+b,M层电子数为a-b |
| M | 单质在自然界中的硬度最大 |
| N | 位于第3周期,最外层电子数是电子层数的2倍 |
(1)写出X、Y、Z、N四种元素的名称:X________________________________________________________________________,
Y______________,Z______________,N____________。
(2)由X、Y、Z、M、N五种元素两两组成的分子中,许多分子含有的电子数相等,写出符合下列要求的分子式:
①含10e-且呈正四面体结构的分子__________;
②含14e-的双原子分子__________;
③含16e-且能使溴水褪色的分子__________;
④含18e-且常温下呈液态的分子__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在水中加入等物质的量的Ag+、Pb2+、Na+、SO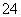 、NO
、NO 、Cl-,该溶液放在用惰性电极材料作电极的电解槽中,通电片刻,则氧化产物与还原产物质量比为( )
、Cl-,该溶液放在用惰性电极材料作电极的电解槽中,通电片刻,则氧化产物与还原产物质量比为( )
A.35.5∶108 B.16∶207
C.8∶1 D.108∶35.5
查看答案和解析>>
科目:高中化学 来源: 题型:
某校化学研究性学习小组的同学在学习了氨气的性质后讨论:既然氨气具有还原性,能否像H2那样还原CuO呢?他们设计实验制取氨气并探究上述问题。请你参与该小组的活动并完成下列实验:
Ⅰ.制取氨气
(1)实验室常用加热氯化铵固体和氢氧化钙固体混合物的方法来制取氨气。写出实验室制取氨气的化学方程式:______________________________________________________。
(2)实验室还可向____________(填一种试剂)中滴加浓氨水的方法快速制取少量氨气。
(3)有同学模仿排饱和食盐水收集氯气的方法,想用排饱和氯化铵溶液的方法收集氨气。你认为能否达到目的?________(填“能”或“否”),理由是___________________。
Ⅱ.实验探究
该小组中某同学设计了下图所示的实验装置(夹持及尾气处理装置未画出)探究氨气的还原性(生成Cu和无污染的物质):

(1)写出氨气与CuO反应的化学方程式:___________________________________。
(2)为达到上述实验目的,预期的实验现象①________________________;②________________________________________________________________________。
(3)该装置在设计上有一定的缺陷,为确保实验结果的准确性,对该装置的改进措施是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
SO2是一种大气污染物,某兴趣小组欲探究SO2的性质及绿色实验方法,设计如下方案:
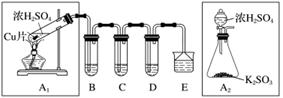
(1)B、C、D分别用于检验SO2的漂白性、还原性和氧化性。其中C、D分别为碘水和硫化氢的水溶液,则B中所盛试剂为__________,C中反应的离子方程式为________________________________________________________________________。
(2)为了实现绿色实验的目标,某同学重新设计了如上右图A2的制取装置来代替A1装置,与A1装置相比,A2装置的优点是____________________________________________________
(任写一点即可)。
(3)E中用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO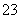 、SO
、SO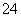 、HSO
、HSO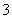 等阴离子。已知亚硫酸氢盐一般易溶于水,SO2也易溶于水。现有仪器和试剂为小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2 mol·L-1盐酸、2 mol·L-1 HNO3、1 mol·L-1 BaCl2溶液、1 mol·L-1 Ba(OH)2溶液、品红溶液、蒸馏水。请设计实验证明“吸收液”中存在SO
等阴离子。已知亚硫酸氢盐一般易溶于水,SO2也易溶于水。现有仪器和试剂为小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2 mol·L-1盐酸、2 mol·L-1 HNO3、1 mol·L-1 BaCl2溶液、1 mol·L-1 Ba(OH)2溶液、品红溶液、蒸馏水。请设计实验证明“吸收液”中存在SO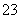 和HSO
和HSO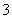 ,完成下表的实验操作、预期现象和结论:
,完成下表的实验操作、预期现象和结论:
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取1 mol·L-1 BaCl2溶液滴入小烧杯中直至过量 | 若出现白色浑浊,则溶液中存在SO |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体______________ | |
| 步骤3: |
查看答案和解析>>
科目:高中化学 来源: 题型:
Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4SOCl2。电池的总反应可表示为4Li+2SOCl2===4LiCl+S+SO2↑。
请回答下列问题:
(1)电池的负极材料为__________,发生的电极反应为
________________________________________________________________________。
(2)电池正极发生的电极反应为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
KHSO4、BaCl2、Na2CO3、FeSO4和氯水五种溶液,如图所示的相互反应,图中每条连线两端的物质可以发生化学反应。下列说法不合理的是( )
A.X一定为KHSO4
B.Y一定为Na2CO3
C.Z可能是氯水
D.M、N必定各为BaCl2、FeSO4中的一种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com