
| A. | 已溶解的溶质和未溶解的溶质质量相等 | |
| B. | 溶质不再溶解,因此从表面看溶质不再减少,也不再增加 | |
| C. | 升高温度,饱和溶液将变为不饱和溶液 | |
| D. | 溶质的溶解和结晶继续进行,且速率相等 |
分析 A.对于饱和溶液而言,已溶解的溶质和未溶解的溶质质量相对大小不定;
B.饱和溶液处于溶解沉淀平衡状态,是一个动态平衡;
C.对于溶解度随温度升高而减小的物质而言,升高温度,饱和溶液仍是饱和溶液;
D.饱和溶液处于溶解沉淀平衡状态,正逆反应速率相等.
解答 解:A.对于饱和溶液而言,已溶解的溶质和未溶解的溶质质量大小不能确定,故A错误;
B.饱和溶液处于溶解沉淀平衡状态,溶质溶解并没有停止,故B错误;
C.对于溶解度随温度升高而减小的物质而言,升高温度,饱和溶液仍是饱和溶液,故C错误;
D.饱和溶液处于溶解沉淀平衡状态,溶质的溶解和结晶继续进行,且速率相等,故D正确;
故选D.
点评 本题考查了饱和溶液,难度不大,注意饱和溶液处于溶解沉淀平衡状态,是一个动态平衡,正逆反应速率相等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
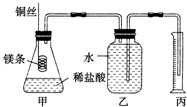 某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答下列问题.该小组设计的简单实验装置如图所示:
某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答下列问题.该小组设计的简单实验装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
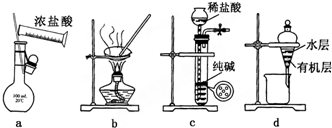
| A. | 用图a所示装置配制100mL0.100mol•L-1稀盐酸 | |
| B. | 用图b所示装置蒸干FeCl3饱和溶液制备FeCl3固体 | |
| C. | 用图c所示装置制取少量纯净的CO2气体 | |
| D. | 用图d所示装置分离CCl4萃取碘水后已分层的有机层和水层 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
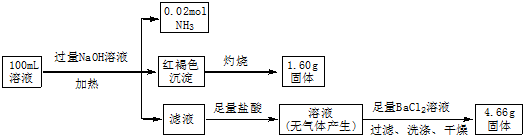
| A. | SO42-、NH4+和Na+ 一定存在,CO32-一定不存在 | |
| B. | SO42-、NH4+一定存在,Na+ 和CO32-一定不存在 | |
| C. | c(Fe3+)=0.1 mol•L-1 | |
| D. | c(Cl-)≥0.4mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 亚硫酸钠 | B. | 硝酸银 | C. | 碳酸钠 | D. | 氯化铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
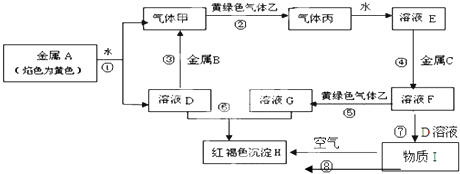
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com