
分析 50mL 0.10 mol•L-1弱酸HA溶液与20mL 0.10 mol•L-1NaOH溶液混合,并稀释到100mL后,所得溶液为0.03mol/L的HA和0.02mol/LNaA的混合溶液,而pH=5.25,即c(H+)=10-5.25mol/L,然后根据HA的K${\;}_{a}^{Θ}$=$\frac{c{(H}^{+})•c({A}^{-})}{c(HA)}$来计算.
解答 解:50mL 0.10 mol•L-1弱酸HA溶液与20mL 0.10 mol•L-1NaOH溶液混合后,生成的NaA的物质的量为0.002mol,过量的HA的物质的量为0.003mol,而稀释至100mL后,所得溶液为0.03mol/L的HA和0.02mol/LNaA的混合溶液,而pH=5.25,即c(H+)=10-5.25mol/L,由于此溶液中,NaA的水解和HA的电离相互抑制,故溶液中的c(A-)≈c(NaA)=0.02mol/L,而溶液中的c(HA)=0.03mol/L,故HA的K${\;}_{a}^{Θ}$=$\frac{c{(H}^{+})•c({A}^{-})}{c(HA)}$=$\frac{1{0}^{-5.25}×0.02}{0.03}$=6.7×10-6.25.
答:HA的电离平衡常数为6.7×10-6.25.
点评 本题考查了混合溶液中的电离平衡常数的计算,难度不大,应注意在混合溶液中物质的水解和电离之间的相互影响.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:选择题
| A. | 用稀硫酸溶解四氧化三铁:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| B. | Ca(HCO2)2溶液中滴加Ba(OH)2溶液至呈中性:Ca2++2HCO3-+Ca2++2OH-═2H2O+BaCO3↓+CaCO3↓ | |
| C. | 向NaHSO4溶液中滴加Ba(OH)2溶液至呈中性:H++SO42-+Ba2++OH-═H2O+BaSO4↓ | |
| D. | 向次氯酸钠溶液中通入SO2:2ClO-+SO2+H2O═SO32-+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式为:CH2=CH2 | |
| B. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| C. | 醋酸的分子式:CH3COOH | |
| D. | 乙醇的结构式为: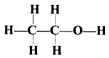 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
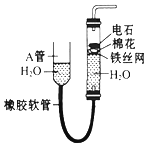 如图中的实验装置可用于制取乙炔.请填空:
如图中的实验装置可用于制取乙炔.请填空:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | XZY3 | B. | X3Z | C. | XZY2 | D. | X2ZY |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com