
分析 碳酸盐、碳酸氢盐均与盐酸反应生成二氧化碳,则先利用氯化钡排除碳酸氢钠的干扰,再利用盐酸、石灰水检验碳酸根离子,以此来解答.
解答 解:纯碱(或碎大理石)中含有碳酸根离子,可以和酸之间反应生成二氧化碳,二氧化碳是无色无味的能使石灰水变浑浊的气体,且应排除碳酸氢根离子的干扰,则设计以下实验进行检验:
①取试样少许于试管中,滴加氯化钡溶液,观察到生成白色沉淀;
②再检验带支管的试管的气密性是良好的;
③然后取试样纯碱(或碎大理石)置试管中,并盖好活塞;
④用针筒取适量盐酸逐滴滴入带支管的试管中,支管的另一头通入澄清的石灰水中,观察到产生气泡,澄清的石灰水变浑浊,反应原理:CaCO3+2HCl=CaCl2+H2O+CO2↑、Ca(OH)2+CO2=CaCO3↓+H2O,
则得出结论为纯碱(或碎大理石)中含有碳酸根离子,
答:①取试样少许于试管中,滴加氯化钡溶液,观察到生成白色沉淀;
②再检验带支管的试管的气密性是良好的;
③然后取试样纯碱(或碎大理石)置试管中,并盖好活塞;
④用针筒取适量盐酸逐滴滴入带支管的试管中,支管的另一头通入澄清的石灰水中,观察到产生气泡,澄清的石灰水变浑浊,
则得出结论为纯碱(或碎大理石)中含有碳酸根离子.
点评 本题考查物质的鉴别和检验,为高频考点,把握离子的检验方法、发生的反应及现象为解答的关键,注意鉴别离子时排除干扰离子,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 用食醋清除暖水瓶中的水垢 | |
| B. | 纤维素在人体内可水解为葡萄糖,故可作为人类的营养物质 | |
| C. | 用热的纯碱水洗涤油垢 | |
| D. | 葡萄糖中花青素在碱性环境下显紫色,故可用苏打粉打粉检验假红酒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X所形成的单质都是双原子分子 | |
| B. | 原子半径X>Y | |
| C. | X、Y能形成的阴、阳离子数之比为1:2离子化合物,其一定为碱性氧化物 | |
| D. | 由X、Y组成的某化合物与水反应能生成一种强碱和一种弱碱,其简单离子半径:X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c>a=d>b | B. | b>a=d>c | C. | c>a>b>d | D. | a=b>c>d |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、SO32-、SO42- | B. | Na+、Ca2+、Cl-、CO32- | ||
| C. | Na+、K+、OH-、Al3+ | D. | Mg2+、Fe2+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液 | B. | AgNO3溶液 | C. | BaCl2溶液 | D. | Ba(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
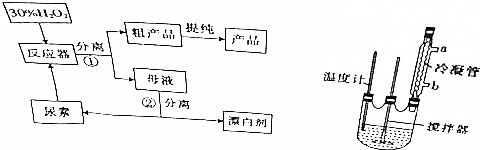
| 分子式 | 外观 | 热分解温度 | 熔点 |
| CO(NH2)2•H2O2 | 白色晶体 | 45℃ | 75~85℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
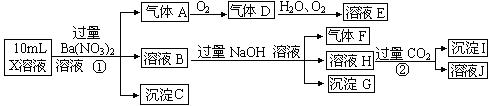
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com