
| A、Mg2+、Na+、SO42-、Cl- |
| B、K+、Ba2+、NO3-、CO32- |
| C、Na+、K+、NO3-、SO32- |
| D、Na+、NH4+、SO42-、NO3- |


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案科目:高中化学 来源: 题型:
| A、SO2的水溶液能导电,故SO2为电解质 |
| B、阳离子在反应中只能得电子被还原做氧化剂 |
| C、标准状况下,6.72L的NH3的物质的量为0.3摩尔 |
| D、氯水、氨水、空气、盐酸、干冰、铁、氧化钠都是混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠与水反应 Na+H2O=Na++OH-+H2↑ |
| B、澄清石灰水中通入足量CO2 Ca2++2OH-+CO2=CaCO3↓+H2O |
| C、NaCl溶液中加入AgNO3溶液 Cl-+Ag+=AgCl↓ |
| D、NaBr溶液中通入氯气 Br-+Cl2=Br2+Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、工业上制备铝是电解熔融的AlCl3 |
| B、可用小苏打发酵面团制作馒头 |
| C、高纯度的单质硅被广泛用于制作计算机芯片 |
| D、热的纯碱可用于除油污 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、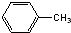 在FeBr3催化作用下与液溴反应生成的一溴代物有4种 在FeBr3催化作用下与液溴反应生成的一溴代物有4种 |
B、1mol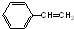 可以和4mol氢气加成 可以和4mol氢气加成 |
C、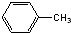 和 和 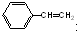 是同系物 是同系物 |
D、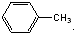 分子中所有原子都处于同一平面 分子中所有原子都处于同一平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
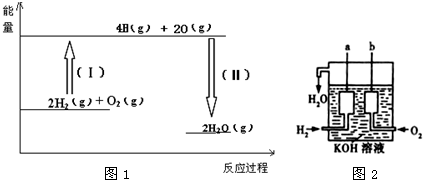
查看答案和解析>>
科目:高中化学 来源: 题型:
| 原子序数 | 电子排布式 | 在周期表中的位置 | 最高价氧化物的水化物化学式及酸碱性 | 气态氢化物的化学式 |
| 14 | ||||
| 1s22s22p63s23p5 | ||||
| 第二周期第VA主族 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com