
| A. | 将水加热,KW增大,pH不变 | |
| B. | 向水中加入少量的NaOH固体,平衡逆向移动,c(OH-)降低 | |
| C. | 向水中加入少量的NH4Cl固体,平衡逆向移动,溶液呈碱性 | |
| D. | 向0.1mol/L的醋酸溶液中加入一定量的醋酸钠晶体,溶液中的c(OH-)增大,KW不变 |
分析 水的电离平衡:H2O?H++OH-中,要使平衡发生移动,应改变溶液c(H+)或c(OH-)的浓度,水的电离是吸热过程,升高温度,平衡向电离方向移动,K增大,c(H+),则pH减小.Kw随温度变化.
解答 解:A、水的电离是吸热过程,加热促进电离,氢离子浓度增大,pH减小,故A错误;
B、向水中加入少量NaOH固体,平衡逆向移动,c(OH-)增大,故B错误;
C、向水中加入少量NH4Cl固体,溶解后铵根离子水解促进电离,平衡正向移动,溶液呈酸性,故C错误;
D、向0.1 mol/L的醋酸溶液中加入一定量醋酸钠晶体溶解后醋酸根离子抑制电离,氢离子浓度减小,加水稀释氢离子浓度减小,依据溶液中离子积不变,溶液中c(OH-)均增大,温度不变,但KW不变,故D正确;故选D.
点评 本题考查水的电离平衡移动,题目难度不大,注意从浓度、温度对平衡移动的影响角度分析,本题易错点为A,注意升高温度c(H+)增大,pH减小.Kw增大.


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 升高温度,正反应速率加快,逆反应速率减慢 | |
| B. | NO不可能全部转化为N2 | |
| C. | CO的转化率为最大值时,该反应达到平衡状态 | |
| D. | 单位时间内消耗NO和CO2的物质的量相等时,反应达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe|H2SO4(稀)|石墨 | B. | Cu|H2SO4(稀)|Cu | C. | Cu|CCl4|Ag | D. | Zn|蔗糖溶液|Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
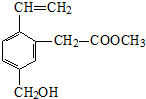
| A. | 能发生水解反应 | B. | 能发生酯化反应 | ||
| C. | 不易溶于水 | D. | 不能使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,16g甲烷所含的质子数为10NA | |
| B. | 常温常压下,18g重水所含的原子数为3NA | |
| C. | 标准情况下,22.4L四氯化碳所含有的分子数为NA | |
| D. | 常温常压下,1mol氦气分子所含有的核外电子数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
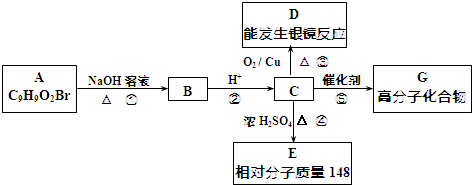
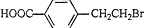 .
.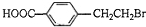 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$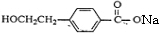 +NaBr+H2O.反应⑤的化学方程式是
+NaBr+H2O.反应⑤的化学方程式是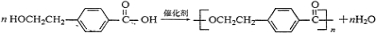 .
.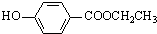 、
、 、还有4种.
、还有4种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:
X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com