
| 序号 | ① | ② |
| pH | 12 | 12 |
| 溶液 | 氨水 | 氢氧化钠溶液 |
| A. | ①②两溶液中c(OH-)相等 | |
| B. | ①②两溶液分别加水稀释10倍,稀释后溶液的pH:①>② | |
| C. | ①溶液的物质的量浓度为0.01mol•L-1 | |
| D. | 等体积的①②两溶液分别与0.01 mol•L-1的盐酸完全中和,消耗盐酸的体积:①>② |
分析 A.pH相等的氨水和氢氧化钠溶液中氢氧根离子浓度相等;
B.pH相等的强碱和弱碱加水稀释,强碱溶液pH变化大;
C.一水合氨是弱电解质,不能完全电离,氢氧化钠是强电解质,完全电离;
D.pH相等的氨水和氢氧化钠溶液中,一水合氨的物质的量比氢氧化钠多.
解答 解:A.pH相等的氨水和氢氧化钠溶液中氢氧根离子浓度相等,故A正确;
B.pH相等的氨水和氢氧化钠溶液加水稀释时,NaOH溶液pH变化大,故B正确;
C.一水合氨是弱电解质,不能完全电离,pH=12的氨水中,其物质的量浓度大于0.01mol/L,故C错误;
D、pH相等的氨水和氢氧化钠溶液中,一水合氨的物质的量比氢氧化钠多,与盐酸中和时消耗的盐酸①>②,故D正确;
故选C.
点评 本题考查了弱电解质的电离平衡及其影响,题目难度中等,明确弱电解质的电离平衡及其影响因素为解答关键,掌握掌握溶液酸碱性与溶液pH的关系,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 干馏煤可以得到甲烷、苯和氨等重要化工原料 | |
| B. | 用于奥运“祥云”火炬的丙烷是一种清洁燃料 | |
| C. | 用大米酿的酒在一定条件下密封保存,时间越长越香醇 | |
| D. | 氯乙烯、聚乙烯、苯乙烯都是不饱和烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠的水解反应:HCO3-+OH-?CO32-+H2O | |
| B. | 向澄清石灰水中加入盐酸:Ca(OH)2+2H+═Ca2++2H2O | |
| C. | Cl2通入热的KOH溶液中制取KClO3:3Cl2+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$ClO3-+5Cl-+3H2O | |
| D. | 苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2C6H5OH+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
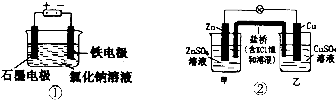
| A. | 装罝①两极均有气泡产生,滴人酚酞溶液后,石墨电极附近溶液变红 | |
| B. | 装置①电解一段时间,加人盐酸溶液可使电解质溶液恢复原状 | |
| C. | 装置②盐桥中的K+向乙池移动 | |
| D. | 装置②反应一段时间后,乙池中溶液的pH变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
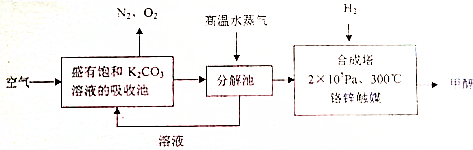
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com