
【题目】常温常压下密度小于水的液体是
A.溴苯B.四氯化碳C.硝基苯D.乙酸乙酯
科目:高中化学 来源: 题型:
【题目】容积固定的密闭容器中,充入一定体积的CO2和H2,发生反应:CO2(g)+3H2(g)![]() CH3OH (g)+H2O(g)。测得不同温度下CO2的物质的量随时间变化如右图。下列说法正确的是( )
CH3OH (g)+H2O(g)。测得不同温度下CO2的物质的量随时间变化如右图。下列说法正确的是( )
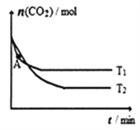
A. 该反应为吸热反应
B. T1、T2对应的平衡常数K1>K2
C. T1时,图中A点的正反应速率小于逆反应速率
D. T2时,若上述反应在压强恒定的密闭容器中进行,达平衡的时间变短
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温钠硫电池是一种新型可充电电池,其工作原理如图所示,图中固体电解质是Na+导体。下列叙述正确的是
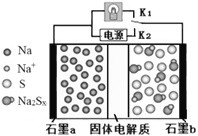
A. 放电时,石墨电极a为正极
B. 放电时,Na+从石墨b向石墨a方向迁移
C. 充电时,b极反应为Na2Sx -2e- = xS+2Na+
D. 可将装置中的固体电解质改成NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表第IB族。元素基态原子3d能级上有__________种不冋运动状态的电子;Cu2+的核外电子排布式为______________________
(2)下图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为__________。

(3)胆矾CuSO4·5H2O可写成[Cu(H2O)]SO4·H2O,其结构示意图如图,下列说法正确的是______(填字母)。

A.在上述结构示意图中,所有氧原子都采用sp3杂化
B.在上述结构示意图中,存在配位键、共价键和离子键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去
(4)S、H、O三种元素的电负性由小到大的顺序是________________。
(5)往硫酸铜溶液中加入过量氨水,首先形成蓝色沉淀,继续添加氨水,沉淀溶解,得到深蓝色透明溶液,可生成[Cu(NH3)4]2+配离子。写出沉淀转化为深蓝色溶液的的离子方程式__________________;已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是_______________________。
(6)Cu2O的熔点比Cu2S的____________(填“高”或“低”),请解释原因____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3),又名大苏打,易溶于水,易被氧化,遇酸易分解;其工业制备原理为2Na2S+Na2CO3+4SO2 ==3Na2S2O3+CO2,用途广泛,其中之一为处理含氰化钠的废水。实验室通过如下图所示装置制备Na2S2O3。

(1)实验中生成SO2的化学方程式_________________________________。
(2)b装置的作用是___________________。
(3)反应开始后,c中观察到逐渐析出了淡黄色固体,后又消失的现象,请用离子方程式解释淡黄色固体出现的原因______________________________________。
(4)实验结束后,在e处最好连接盛_________的仪器,目的是___________________。
(5)为了提高产品的产量,通入的SO2不能过量,原因是___________________。
(6)测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量。
己知:①废水中氰化钠的最高排放标准为0.50 mg/L;
②Ag++2CN-=[Ag(CN)2]-,Ag++I- =AgI↓,AgI呈黄色,且CN-优先与Ag+反应。
实验如下:取20.00 mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.00×10-4mol/L的标准六AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50mL。
滴定终点的现象:_____________________;处理后的废水是否达到排放标准:____________(填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】57号镧元素(La)是一种活泼性比铁还强的金属元素,La的氧化物的化学式为La2O3,La(OH)3是不溶于水的碱,La的氯化物、硝酸盐均易溶于水,下列各组物质中不能直接反应得到LaCl3的是
A. La2O3+HCl B. La+Cl2
C. La(OH)3+HCl D. La(NO3)3+HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素甲、乙、丙、丁、戊在元素周期表中的位置如表所示,其中丁所处的主族序数是其周期序数的三倍。回答下列问题:
乙 | 丙 | 丁 | |
甲 | 戊 |
(1)乙在元素周期表中的位置是___________________。
(2)原子半径:戊____甲(填“>”或“<”)。
(3)乙与戊组成化合物的电子式为________________,其中化学键的类型是________(填“极性”或“非极性”)共价键。
(4)元素的非金属性:甲____丙(填“>”或“<”),下列事实能说明该结论的是_______。
A、丙的氢化物稳定,甲的氢化物不稳定
B、丙的最高价氧化物对应的水化物是强酸,甲的是弱酸
C、丙的最高价氧化物对应的水化物易溶于水,甲的难溶
(5)工业上制取甲(粗品)的化学方程式_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 乙烯和乙醇都能发生加成反应
B. 乙酸和四氯化碳都可萃取溴水中的Br2
C. 苯和四氟乙烯分子中的所有原子均处于同一平面
D. 糖类、油脂及蛋白质均只由碳、氢、氧三种元素组成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com