
【题目】工业采用氯化铵焙烧菱锰矿制备碳酸锰的流程如下图所示: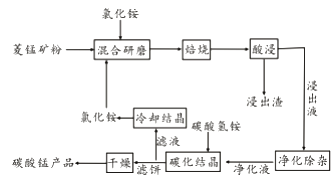
已知:①菱锰矿的主要成分是MnCO3 ,其中含Fe、Ca、Mg、Al等元素。
②焙烧过程中主要反应为:MnCO3 +2NH4Cl ![]() MnCl2+2NH3↑ +CO2↑+ H2O。
MnCl2+2NH3↑ +CO2↑+ H2O。
③部分阳离子沉淀时溶液的pH的值:
Al3- | Fe3+ | Ca2+ | Mn2+ | Mg2+ | |
开始沉淀的pH值 | 4.1 | 2.2 | 10.6 | 8.8 | 9.6 |
沉淀完全的pH值 | 4.7 | 3.2 | 13.1 | 10.1 | 11.1 |
(1)实验室“焙烧”操作盛放固体的仪器为。
(2)结合图1、2、3,分析焙烧过程中对温度、NH4Cl用量[m(NH4Cl):m(锰矿粉)]、时间的最佳选择依次为、、。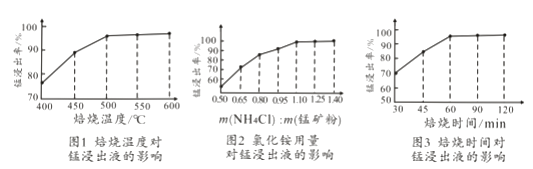
(3)对锰浸出液净化除杂时,先加入MnO2将Fe2+转化为Fe3+ , 再调节溶液pH的范围为 , 将Fe3+和Al3+变为沉淀除去。然后加入NH4F将Ca2+、Mg2+变为氟化物沉淀除去。
(4)“碳化结晶”步骤中,加入碳酸氢铵是反应的离子方程式为。
(5)上述流程中可循环使用的物质是。
(6)为测定产品中碳酸锰的含量,设计如下实验(杂质不参加反应):实验步骤为:称取16.80g试样,溶于适量的稀硫酸溶液中,向所得溶液中加入稍过量的磷酸和硝酸,加热使反应:2Mn2++NO3-+4PO43-+2H+ ![]() 2[Mn(PO4)2]3-+NO2-+H2O充分进行。除去溶液中存在的NO3-和NO2-后,加入l00.00mL2.00 mol·L-1的(NH4)2Fe(SO4)2溶液,发生的反应为:[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO3-;再用1.00mol·L-1酸性K2Cr2O7溶液滴定过量的Fe2+ , 滴定终点时消耗10.00mL酸性K2Cr2O7溶液。
2[Mn(PO4)2]3-+NO2-+H2O充分进行。除去溶液中存在的NO3-和NO2-后,加入l00.00mL2.00 mol·L-1的(NH4)2Fe(SO4)2溶液,发生的反应为:[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO3-;再用1.00mol·L-1酸性K2Cr2O7溶液滴定过量的Fe2+ , 滴定终点时消耗10.00mL酸性K2Cr2O7溶液。
①酸性K2Cr2O7溶液与Fe2+反应的离子方程式为(还原产物是Cr3+)。
②产品中碳酸锰的质量分数为(结果保留3位有效数字)。
【答案】
(1)坩埚
(2)500℃;1.10∶1;60min
(3)4.7≤pH<8.8
(4)Mn2++2HCO3-=MnCO3↓+CO2↑+H2O
(5)NH4Cl
(6)6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;95.8%或0.958
【解析】(1)实验室固体“焙烧”通常在坩埚中进行;
(2)随着温度的升高,锰浸出率逐渐升高,但是500℃以后,锰浸出率增加缓慢,并且在500℃时,锰浸出率已经达到95%以上,从节约能源的角度考虑,焙烧温度取500℃即可;当氯化铵与锰矿粉质量比为1.1:1时,锰浸出率已经达到95.8%,继续增加氯化铵用量,锰浸出率提高不明显,因此,选择氯化铵与锰矿粉质量比为1.1:1;焙烧时间为1h时锰浸出率达到最大,超过1h锰浸出率趋于平缓,因此,实验选择适宜的焙烧时间为1h;
(3)在80℃~90℃时,加入MnO2将Fe2+氧化为Fe3+ , 调节溶液的pH在“4.7≤pH<8.8”,水解沉淀Fe3+ , 此时Al3+也水解为Al(OH)3沉淀;
(4)“碳化结晶”时,加入碳酸氢铵是HCO3-的电离促进Mn2+生成MnCO3溶液,同时HCO3-与电离出的H+结合成水和CO2 , 发生反应的离子方程式为Mn2++2HCO3-=MnCO3↓+CO2↑+H2O;
(5)“碳化结晶”时副产物为NH4Cl,可作为原料循环使用;
(6)①Fe2+有还原性,能被酸性K2Cr2O7溶液氧化为Fe3+ , 同时K2Cr2O7被还原为Cr3+ , 发生反应的离子方程式为6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;K2Cr2O7的物质的量为1.00 mol·L-1×0.01L=0.01 mol,过量Fe2+的物质的量为0.01 mol×6=0.06mol,则与[Mn(PO4)2]3-反应的Fe2+的物质的量为2.00 mol·L-1×0.1L-0.06mol =0.14 mol,根据Mn2+~[Mn(PO4)2]3-~Fe2+ , 可知Mn2+的物质的量为,则样品中碳酸锰的质量分数为(0.14mol×115g/mol)÷16.80g×100%=95.8%。


科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)是一种白色晶体,无臭无味,能潮解,难溶于水,可与水缓慢反应;不溶于醇类、乙醚等,易与酸反应,常用作杀菌剂、防腐剂等。通常利用CaCl2在碱性条件下与H2O2反应制得。
某化学兴趣小组在实验室制备CaO2的实验方案和装置示意图(图一)如下:


请回答下列问题:
(1)三颈烧瓶中发生的主要反应的化学方程式为___________________________________;
(2)支管B的作用是_________________________;
(3)步骤③中洗涤CaO2·8H2O的液体X的最佳选择是____________;
A.无水乙醇 B.浓盐酸 C.水 D.CaCl2溶液
(4)过氧化钙可用于长途运输鱼苗,这体现了过氧化钙___________的性质;
A.可缓慢供氧 B.能吸收鱼苗呼出的CO2气体 C.能潮解 D.可抑菌
(5)已知CaO2在350℃时能迅速分解,生成CaO和O2。该小组采用如图二所示的装置测定刚才制备的产品中CaO2的纯度(设杂质不分解产生气体)
①检查该装置气密性的方法是:_________________________________;
②使用________(填仪器名称)准确称取0.5000g样品,置于试管中加热使其完全分解,收集到33.60mL(已换算为标准状况)气体,则产品中过氧化钙的质量分数为________(保留4位有效数字);
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各选项中,各类物质依次表示为X、Y、Z,其中与图中三个圆所示的从属关系不相符的是:

A. 氧化物、化合物、纯净物
B. 胶体、分散系、混合物
C. 复分解反应、置换反应、化学反应
D. 碱性氧化物、金属氧化物、氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图,a处通入Cl2,当打开b阀时,c处的干燥的红布条没有明显变化,当关闭b阀时.c处的干燥红布条逐渐褪色,则d瓶中装的溶液可能是
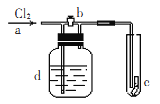
A. NaOH溶液 B. 饱和食盐水 C. Ca(OH)2溶液 D. 浓H2S04
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 标准状况下,22.4L CO所含原子的物质的量为1mol
B. 33.6L NH3气体所含分子的物质的量为1.5mol
C. 同温同压下,相同体积的物质,其物质的量一定相等
D. 同温同压下,一氧化碳气体和氮气,若体积相等,则质量一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列做法对人体健康不会造成危害的是( )
A.用工业盐(NaNO2)作咸味调味品
B.用硫磺熏制银耳,使它颜色更白
C.食盐中加入一定量的碘酸钾(KIO3)制取加碘食盐
D.将含有甲醇(CH3OH)的工业酒精兑制成饮用白酒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸异戊酯( ![]() )是一种香料,一种合成路线如下:
)是一种香料,一种合成路线如下: 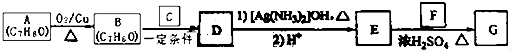 已知以下信息:
已知以下信息:
① ![]() ;
;
②C为甲醛的同系物,相同条件下其蒸气与氢气的密度比为22.
回答下列问题:
(1)A的化学名称为 .
(2)B和C反应生成D的化学方程式为 .
(3)F中含有官能团的名称为 .
(4)E和F反应生成G的化学方程式为 , 反应类型为 .
(5)F的同分异构体中不能与金属钠反应生成氢气的共有种(不考虑立体异构),其中核磁共振氢谱只有两组峰,且峰面积比为3:1的为写结构简式).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com