
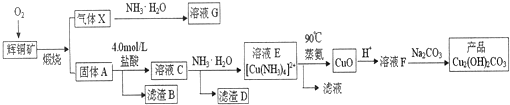
分析 辉铜矿通入氧气充分煅烧,生成B为二氧化硫气体,固体A主要为CuO、Fe3O4,加入盐酸得到含有Cu2+、Fe3+的溶液,加入过量氨水,可得到[Cu(NH3)4]2+和Fe(HO)3,[Cu(NH3)4]2+经加热可得到CuO,加入酸酸化得到Cu2+,经浓缩后在溶液中加入碳酸钠可得到碱式碳酸铜,以此解答该题;
(1)配制500mL溶液,依据溶液配制过程和方法判断需要的仪器,需要500mL容量瓶,还需要胶头滴管定容;
(2)滤渣B为二氧化硅,可用于工业上制取粗硅,高温下二氧化硅和碳反应生成硅和一氧化碳;
(3)上述分析可知,溶液C中含有铁离子和铜离子,加入过量氨水,沉淀铁离子,Cu(OH)2可以溶于NH3•H2O生成[Cu(NH3)4]2+;
(4)[Cu(NH3)4]2+经加热可得到CuO,反应过程是:①[Cu(NH3)4]2+(aq)?Cu2+(aq)+4NH3(aq);铜离子水解生成氢氧化铜,氢氧化铜分解生成氧化铜;
(5)气体X为二氧化硫气体,可以用NH3•H2O吸收得到溶液G为亚硫酸铵,亚硫酸根离子分步水解得到亚硫酸氢根和氢氧根离子,亚硫酸氢根离子水解生成亚硫酸和氢氧根离子;
(6)溶液F为CuSO4溶液,以石墨作电极电解溶液,阴极析出铜mg,依据铜元素守恒计算辉铜矿中Cu2S的质量百分数.
解答 解:(1)配制500mL溶液,依据溶液配制过程和方法判断需要的仪器,所需的玻璃仪器除烧杯、量筒、玻璃棒外,还需要500mL容量瓶配制溶液,用胶头滴管定容;
故答案为:500mL容量瓶;胶头滴管;
(2)上述分析可知,滤渣B为二氧化硅,可用于工业上制取粗硅,高温下二氧化硅和碳反应生成硅和一氧化碳,反应的化学方程式为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO;
故答案为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO;
(3)溶液C中含有铁离子和铜离子,加入过量氨水,沉淀铁离子,Cu(OH)2可以溶于NH3•H2O生成[Cu(NH3)4]2+,所以向溶液C中加入氨水必须过量,其目的是使Cu2+完全转化为[Cu(NH3)4]2+,防止因生成Cu(OH)2沉淀而损失,过滤得到滤渣D为Fe(OH)3;
故答案为:使Cu2+完全转化为[Cu(NH3)4]2+,防止因生成Cu(OH)2沉淀而损失;Fe(OH)3;
(4)[Cu(NH3)4]2+经加热可得到CuO,反应过程是:①[Cu(NH3)4]2+(aq)?Cu2+(aq)+4NH3(aq);②铜离子水解生成氢氧化铜,反应的离子方程式为:Cu2++2H2O?Cu(OH)2+2H+;③氢氧化铜分解生成氧化铜,反应的化学方程式为:Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CuO+H2O;
故答案为:Cu2++2H2O?Cu(OH)2+2H+;Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CuO+H2O;
(5)气体X为二氧化硫气体,可以用NH3•H2O吸收得到溶液G为亚硫酸铵,亚硫酸根离子分步水解得到亚硫酸氢根和氢氧根离子,亚硫酸氢根离子水解生成亚硫酸和氢氧根离子,所以溶液G中的阴离子除了OH-外还有SO32-,HSO3-;
故答案为:SO32-,HSO3-;
(6)溶液F为CuSO4溶液,以石墨作电极电解溶液,阴极析出铜mg,由铜元素守恒可知n(Cu2S)=$\frac{1}{2}$n(Cu)=$\frac{1}{2}$×$\frac{mg}{64g/mol}$=$\frac{m}{128}$mol,则辉铜矿中Cu2S的质量百分数=$\frac{\frac{m}{128}mol×160g/mol}{ag}$×100%=$\frac{160m}{128a}$×100%,故答案为:$\frac{160m}{128a}$×100%.
点评 本题考查了物质分离提纯的分析判断,物质性质的理解应用,离子方程式和化学方程式书写的应用,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 呈酸性 | B. | 呈中性 | C. | 呈碱性 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 金属 | 颜色 | 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 比热[KJ/kg•℃] |
| Fe | 银白色 | 7.86 | 1 535 | 2 750 | 0.44 |
| Cu | 红色 | 8.92 | 1 083 | 2 567 | 0.38 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CH=CH2),聚苯乙烯的化学式为
CH=CH2),聚苯乙烯的化学式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
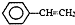 ),聚苯乙烯的化学式为
),聚苯乙烯的化学式为
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 浓度/mol•L-1 时间 | c(NH3) | c(O2) | c(NO) |
| 0min | 1.000 | 1.600 | 0.000 |
| 2min | 0.600 | a | 0.400 |
| 4min | 0.500 | 0.975 | 0.500 |
| 6min | 0.500 | 0.975 | 0.500 |
| 8min | 0.700 | 1.225 | 0.750 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第5周期第IA族 | B. | 第4周期第IA族 | C. | 第3周期第IA族 | D. | 第3周期第IA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化铜(铜) | B. | 碳酸钙(氯化银) | C. | 氢氧化铁(氯化铁) | D. | 氢氧化钠(氯化钠) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com