
| A. | 新制的氯水保存在棕色广口瓶中,并放在阴凉处 | |
| B. | 波尔多液(CuSO4与石灰水按一定比例混合)盛放在铁制容器中 | |
| C. | 烧碱溶液放在带玻璃塞的磨口试剂瓶中 | |
| D. | 金属钠保存在煤油中 |
分析 A.液体放在细口瓶中,见光易分解的放在棕色瓶中;
B.铜离子和Fe发生置换反应;
C.烧碱能和玻璃的成分之一二氧化硅反应生成硅酸钠,是一种粘合剂;
D.金属钠属于活泼金属,易与水、氧气反应,需隔绝空气,煤油密度小于钠,且与钠不反应.
解答 解:A.氯水见光时其中的次氯酸会分解生成盐酸和氧气,并且属于液体,所以盛放在棕色细口瓶中,故A错误;
B.波尔多液中CuSO4能与Fe发生置换反应,不能盛放在铁制容器中,应该盛放在陶瓷容器中,故B错误;
C.烧碱能和玻璃中的二氧化硅反应生成硅酸钠,是一种粘合剂,会使瓶塞打不开,故应盛放在带有橡胶塞的试剂瓶中,故C错误;
D.金属钠易与空气中氧气反应、易与水反应,与煤油不反应且密度比煤油小,保存在煤油中可隔绝空气,防止钠变质,故D正确;
故选D.
点评 本题考查了试剂的存放和药品的保存,题目难度不大,属于实验基础题型,应注意易挥发药品要密封保存,易分解物质和避光、低温保存,具体物质要具体分析.


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:解答题
| 实验序号 | 反应温度/℃ | H2C2O4溶液 | 酸性KMnO4溶液 | H2O | ||
| V/mL | c(mol•L-1) | V/mL | c(mol•L-1) | V/mL | ||
| ① | 25 | 8.0 | 0.20 | 5.0 | 0.010 | 0 |
| ② | 25 | 6.0 | 0.20 | 5.0 | 0.010 | x |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3Cl2+6NaOH=2NaClO3+5NaCl+3H2O | |
| B. | CaH2+2H2O=Ca(OH)2+2H2↑ | |
| C. | AlCl3+3NaAlO2+6H2O=4Al(OH)3↓+3NaCl | |
| D. | 2CuO+Cu2S=4Cu+SO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| T | 最外层电子数是电子层数的2倍 |
| Z | 元素最高正价是+7价 |
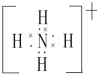 (用元素符号表示).
(用元素符号表示).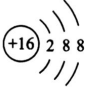 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
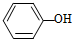
 、CH 3COOH、HCl的排列中,
、CH 3COOH、HCl的排列中, 应填入的物质是( )
应填入的物质是( )| A. | H2SO4 | B. | CH3CH2OH | C. | H2CO3 | D. | CH3COOCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1硫化钠溶液中离子浓度关系:c(Na+)=2[c(S2-)+c(HS-)+c(H2S)] | |
| B. | 常温下醋酸分子不可能存在于pH>7的碱性溶液中 | |
| C. | 常温下向氯化铵溶液中加入少量氨水使溶液的pH=7,则混合溶液中:c(Cl-)>c(NH4+) | |
| D. | 0.1mol•L-1的氯化铵溶液与0.05mol•L-1的氢氧化钠溶液等体积混合后,混合溶液中离子浓度:c(Cl-)>c(NH4+)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入Cu(OH)2浊液之前,未用NaOH溶液中和硫酸 | |
| B. | 制Cu(OH)2时,硫酸铜溶液太稀,NaOH过量了 | |
| C. | 加热时间不充分,淀粉没有充分水解 | |
| D. | 所用淀粉浓度不够 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 混合物 | 试剂 | 分离方法 | |
| A | CO2(HCl) | 饱和Na2CO3溶液 | 洗气 |
| B | 乙烷(乙烯) | 氢气 | 加热 |
| C | 溴(水) | 乙醇 | 蒸馏 |
| D | 乙醇(水) | 新制生石灰 | 蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com