
| A. | Na暴露于空气中最终生成Na2O2 | |
| B. | 铜粉能溶于酸性硝酸钠溶解 | |
| C. | Fe比Al更易与NaOH溶液反应生成H2 | |
| D. | 水蒸气通过灼热的铁粉会有红棕色固体生成 |
分析 A.Na在空气中不稳定,易生成Na2O、Na0H,最终生成Na2CO3;
B.根据铜与硝酸根离子在酸性条件下能发生氧化还原反应;
C.铁和氢氧化钠溶液不反应,铝和氢氧化钠溶液反应生成偏铝酸钠和氢气;
D.铁和水蒸气反应生成黑色四氧化三铁和氢气;
解答 解:A.钠和空气中氧气反应生成氧化钠,氧化钠溶于水生成氢氧化钠,氢氧化钠和二氧化碳反应生成碳酸钠,结晶析出碳酸钠晶体,失水得到白色粉末碳酸钠,故A错误;
B.根据铜与硝酸根离子在酸性条件下能发生氧化还原反应:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,铜粉能溶于酸性硝酸钠溶解,故B正确;
C.铁和氢氧化钠溶液不反应,铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故C错误;
D.水蒸气通过灼热的铁粉会有黑色固体生成,3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,故D错误;
故选B.
点评 本题主要考查了物质的性质和反应产物的判断,难度不大,注意硝酸根离子在酸溶液中的氧化性,铝与碱溶液反应的特殊性质,根据课本知识即可完成.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 油脂在空气中完全燃烧转化为水和二氧化碳 | |
| B. | 蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体 | |
| C. | 用于食品包装的塑料制品,属于热塑性塑料,可回收再利用 | |
| D. | 聚氯乙烯塑料强度大,抗腐蚀性强,可以用来包装需长时间保存的食品 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①中产生气泡,②中不产生气泡 | |
| B. | ①和②中都不产生气泡 | |
| C. | ①和②中都产生气泡,①中是H2,②中是O2 | |
| D. | ①和②中都产生气泡,且都是H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
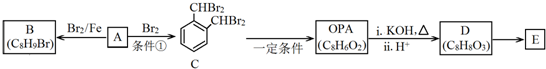
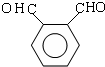 .
.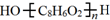 .D→E的化学方程式是n
.D→E的化学方程式是n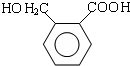 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$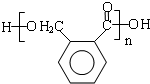 +(n-1)H2O(不必注反应条件).
+(n-1)H2O(不必注反应条件).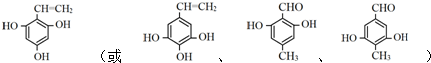 (写1种即可).
(写1种即可).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
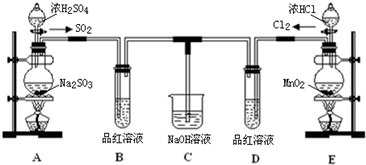
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
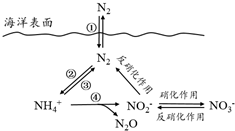 氮元素在海洋中的循环,是整个海洋生态系统的基础和关键.海洋中无机氮的循环过程可用如图表示.
氮元素在海洋中的循环,是整个海洋生态系统的基础和关键.海洋中无机氮的循环过程可用如图表示.| 温度/℃ | 样本氨氮含量/mg | 处理24h | 处理48h |
| 氨氮含量/mg | 氨氮含量/mg | ||
| 20 | 1008 | 838 | 788 |
| 25 | 1008 | 757 | 468 |
| 30 | 1008 | 798 | 600 |
| 40 | 1008 | 977 | 910 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、NH4+、SCN-、Cl- | B. | K+、Na+、SO42-、HCO3- | ||
| C. | Na+、Ba2+、Cl-、NO3- | D. | A13+、Na+、A1O2-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com