
【题目】向FeBr2、FeI2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示,下列有关说法中不正确的是( )
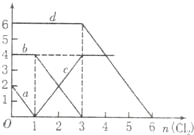
A.d曲线代表溶液中Br﹣变化情况
B.原溶液中FeI2的物质的量为2mol
C.原溶液中n(Fe2+):n(Br﹣)=2:3
D.当通入2mol Cl2时,溶液中离子反应为:2Fe2++2I﹣+2Cl2═2Fe3++I2+4Cl﹣
【答案】B
【解析】
试题分析:首先根据氧化还原反应中:氧化剂的氧化性>氧化产物的氧化性,还原剂的还原性>还原产物的还原性,氧化剂先氧化还原性强的离子,再氧化还原性弱的离子,判断离子的反应先后顺序,然后根据图象判断参加反应的各离子的物质的量,以此解答该题.
解:A.反应2Fe2++Br2=2Fe3++2Br﹣中,还原剂Fe2+的还原性强于还原产物Br﹣,所以还原性:Fe2+>Br﹣,反应2Fe3++2I﹣=2Fe2++I2中,还原剂I﹣的还原性强于还原产物Fe2+,所以还原性:I﹣>Fe2+,所以还原性I﹣>Fe2+>Br﹣,则通入氯气,先与碘离子反应,再与Fe2+反应,a对应氯气与碘离子的反应,c对应氯气与亚铁离子反应,当加3mol氯气时溴离子开始反应,则d曲线代表溶液中Br﹣变化情况,故A正确;
B.通入氯气后,碘离子先被氧化,其次是亚铁离子,最后是溴离子,在通入氯气的量为0~1mol的过程中,碘离子从最大量降到0,即得到碘离子的物质的量为2mol,通入氯气的量为1~3mol的过程中,亚铁离子从4mol降到0,三价铁的量逐渐增大,所以含有亚铁离子共4mol,在通入氯气的量为3~6mol的过程中溴离子从6ml降到0,所以溴离子的物质的量是6mol,即FeBr2的物质的量为3mol,FeI2的物质的量为1mol,故B错误;
C.由B可知,亚铁离子是4mol,溴离子的物质的量是6mol,n(Fe2+):n(Br﹣)=2:3,故C正确;
D.当通入2molCl2时,2mol的I﹣消耗氯气1mol,余下的1mol氯气再与2molFe2+反应,即溶液中发生的离子反应可表示为2Fe2++2I﹣+2Cl2=2Fe3++I2+4Cl﹣,故D正确.
故选B.


科目:高中化学 来源: 题型:
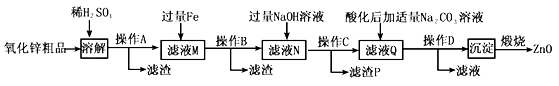
【题目】活性氧化锌用作橡胶硫化的活性剂、补强剂。以氧化锌粗品(含铁的氧化物、CuO和SiO2等杂质)为原料制备活性氧化锌并生产其它副产品的生产工艺流程如下:
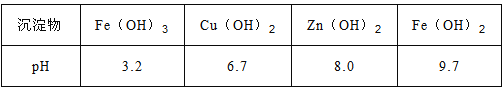
已知:Zn(OH)2可溶于NaOH溶液。一些阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
(1)操作A所用的玻璃仪器有烧杯、漏斗和______________。
(2)“溶解”前将氧化锌粗品粉碎成细颗粒,目的是____________________。
(3)加入过量铁可回收的金属是_______________。
(4)常温下若向滤液N中加入适量的H2O2溶液,再加一定量某试剂调节溶液pH=5,则Fe3+浓度为__________(已知Ksp[Fe(OH)3]=4.0×10-34)
(5)用K3[Fe(CN)6](铁氰化钾)验证N中Fe2+的现象是___________。
(6)“沉淀”的成分为ZnCO3·2Zn(OH)2·H2O,“煅烧”在450~500℃下进行,煅烧获得ZnO的反应的化学方程式为_____________________。
(7)取20.00mL滤渡N,用0.02mol/L的KMnO4溶液进行滴定,消耗KMnO4溶液18.00mL,则滤液N中Fe2+的浓度为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,能进行如图所示的多种反应。
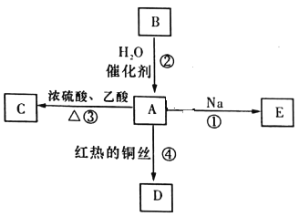
(1)写出D的官能团名称_____________________。
(2)写出反应③的化学方程式____________________。
(3)发生反应①时钠在____________________。(填“液面上”或“液体底部”)。
(4)写出反应②的反应类型___________。
(5)比B多一个碳原子的B的同系物,在一定条件下可发生聚合反应,生成一种高分子化合物,请写出该反成的化学方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.0.5mol/LFe2(SO4)3溶液中,SO42-的数目为1.5NA
B.7.1gCl2与足量NaOH溶液反应转移的电子数为0.2NA
C.5.6 g铁与0.1 mol氯气充分反应转移电子数为 0.2NA
D.在0.1mol蓝矾晶体和1L 0.1moL·L![]() AlCl3溶液中,金属阳离子总数均小于0.1NA
AlCl3溶液中,金属阳离子总数均小于0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项中,有关实验操作、现象和结论都正确的是( )
选项 | 实验操作 | 现 象 | 结 论 |
A | 将过量的CO2通入CaCl2溶液中 | 无白色沉淀出现 | 生成的Ca(HCO3)2可溶于水 |
B | 常温下将Al片插入浓硫酸中 | 无明显现象 | Al片和浓硫酸不反应 |
C | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
D | 将SO2通入溴水中 | 溶液褪色 | SO2具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S水溶液中存在电离平衡H2S![]() H++HS-和HS-
H++HS-和HS-![]() H++S2-,若向H2S溶液中
H++S2-,若向H2S溶液中
A.加水,平衡向右移动,溶液中氢离子浓度增大
B.通入过量SO2气体,平衡向左移动,溶液pH值增大
C.滴加新制氯水,平衡向左移动,溶液pH值减小
D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时纯水的电离度为a1,pH=2的醋酸溶液中水的电离度为a2,pH=12的氢氧化钠溶液中水的电离度为a3。若将上述醋酸与氢氧化钠溶液等体积混合,所得溶液中水的电离度为a4。下列关系式中正确的是
A.a2 = a3<a4<a1 B.a3 = a2<a1<a4
C.a2<a3<a1<a4 D.a1<a2<a3<a4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下CH3COOH和NH3·H2O的电离常数相等,向10ml浓度为0.1mol/L的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中
A.水的电离程度始终增大
B. 先增大再减小
先增大再减小
C.c(CH3COOH)与c(CH3COO-)之和始终保持不变
D.当加入氨水的体积为10mL时c(NH4+)=c(CH3COO-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com