


 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:
| P1 | P2 | P3 | |
| T1 | 0.10 | 0.04 | 0.02 |
| T2 | 0.20 | 0.16 | 0.05 |
| T3 | 0.40 | 0.35 | 0.20 |
| c(HCO3) | ||
c(C
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

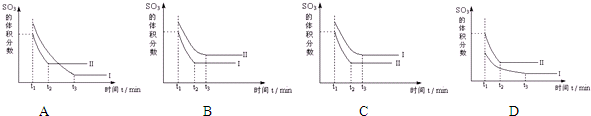
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
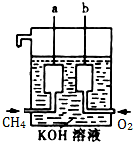 美国阿波罗宇宙飞船上使用了一种新型装置,其构造如图所示:
美国阿波罗宇宙飞船上使用了一种新型装置,其构造如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
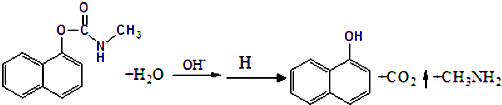
| A、西维因分子式为C12H10NO2 |
| B、反应后的溶液经酸化,不可用FeCl3溶液检验西维因是否已经发生水解 |
| C、水解后的两种有机产物,各有一种官能团 |
| D、西维因分子中至少有21个原子共平面 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com