
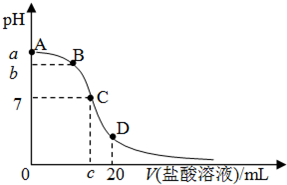
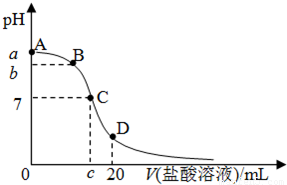
 25℃,在20mL 0.1mol?L-1氨水溶液中逐滴加入0.1mol?L-1HCl溶液,其pH与所加盐酸溶液体积(V/mL)的关系如图所示,下列说法正确的是( )
25℃,在20mL 0.1mol?L-1氨水溶液中逐滴加入0.1mol?L-1HCl溶液,其pH与所加盐酸溶液体积(V/mL)的关系如图所示,下列说法正确的是( )| A、在D点:c(NH4+)+c(NH3?H2O)=c(Cl-) | B、在C点,V1<10,且有c(NH4+)=c(Cl-)=c(OH-)=c(H+) | C、在A、C间任一点,溶液中一定都有:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | D、已知25℃时 0.1 mol?L-1氨水电离度为1.33%,则b<a<12 |


 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:
| A、已知25℃时NH4CN水溶液显碱性,则25℃时的电离常数K(NH3?H2O)>K(HCN) | B、25℃时,Mg(OH)2固体在20 mL 0.01mol?L-1氨水中的Ksp比在20mL 0.01mol?L-1 NH4Cl溶液中的Ksp小 | C、pH试纸测得新制氯水的pH为4.5 | D、FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3 |
查看答案和解析>>
科目:高中化学 来源:常州三模 题型:多选题
| A.在A、C间任一点,溶液中一定都有:c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| B.在C点,c<10,且有c(NH4+)=c(Cl-)=c(OH-)=c(H+) |
| C.若25℃时 0.1mol/L 氨水电离度为1.33%,则b<a<12 |
| D.在D点:2c(NH4+)+2c(NH3?H2O)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源:2011年江苏省常州市高考化学三模试卷(解析版) 题型:选择题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com