
绿矾(FeSO4·7H2O)是治疗缺铁性盆血药品的重要成分.实验室利用硫酸厂烧渣(主要成分为Fe2O3及少量FeS、SiO2等)制备绿矾的过程如下:

(1)固体W焙烧时产生某有毒气体,需以碱液吸收处理之,下列装置A~D中可选用________(填字母);若选用E装置,则烧杯中的下层液体可以是________(填名称).

(2)实验过程中多次使用过滤操作.过滤操作中用到的玻璃仪器有________.
(3)写出溶液X中加铁屑发生反应的离子方程式________.
(4)测定绿矾产品中Fe2+含量的实验步骤:
a.称取5.7 g绿矾产品,溶解,在250 mL容量瓶中定容;
b.量取25 mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01 mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液体积为40 mL(滴定时发生反应的离子方程式为:5Fe2++MnO![]() +8H+=5Fe3++Mn2++4H2O)
+8H+=5Fe3++Mn2++4H2O)
①计算上述产品中FeSO4·7H2O的质量分数为________.
②若用上述方法测定的产品中FeSO4·7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因有(只回答一条即可)________.
科目:高中化学 来源:2012届江西省吉安一中高三上学期期中考试化学试卷 题型:填空题
(10分)以黄铜矿(主要成份为CuFeS2,含少量杂质SiO2等)为原料,进行生物炼铜,同时得到副产品绿矾(FeSO4·7H2O)。其主要流程如下: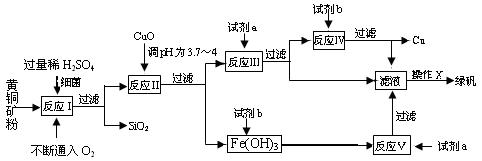

已知:①4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O;
②部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的p H如下表:
H如下表:
| 沉淀物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 4.7 | 2.7 | 7.6 |
| 完全沉淀pH | 6.7 | 3.7 | 9.6 |
查看答案和解析>>
科目:高中化学 来源:2011届浙江省金华一中高三高考模拟考试(理综)化学部分 题型:实验题
(16分)已知硫酸亚铁铵晶体为浅绿色,易溶于水、不溶于乙醇,在水中的溶解度比FeSO4和(NH4)2SO4都要小;能水解;具有还原性,但比硫酸亚铁稳定。
以下是将绿矾(FeSO4?7H2O)、硫酸铵以相等物质的量混合可制得摩尔盐晶体的流程图。根据下图回答:
(1)为处理废铁屑表面的油污,用10%Na2CO3溶液清洗,请用离子方程式表示Na2CO3溶液呈碱性的原因: ▲ 。
(2)步骤1中采用倾析法分离出铁屑,下列适合用倾析法的有 ▲ :
A.沉淀的颗粒较大 B.沉淀容易沉降 C.沉淀呈胶状 D.沉淀呈絮状
(3)步骤2 中铁屑过量的目的是(用离子方程式表示): ▲ 。步骤2中溶液趁热过滤的原因是 ▲ 。
中铁屑过量的目的是(用离子方程式表示): ▲ 。步骤2中溶液趁热过滤的原因是 ▲ 。
(4)步骤3中,加入(NH4)2SO4固体后,应 加热到 ▲ 时,停止加热。需经过的实验操作包括: ▲ 、 ▲ 、减压过滤(或抽滤)等得到较为 ▲ 的晶体。
加热到 ▲ 时,停止加热。需经过的实验操作包括: ▲ 、 ▲ 、减压过滤(或抽滤)等得到较为 ▲ 的晶体。
(5)抽滤装置的仪器有: ▲ 、 ▲ 、安全瓶、抽气泵组成。
(6)产品中Fe2+的定量分析:
制得的摩尔盐样品中往往含有极少量的Fe3+。为了测定摩尔盐产品中Fe2+的含 量,一般采用在酸性下用KMnO4标准液滴定的方法。
量,一般采用在酸性下用KMnO4标准液滴定的方法。
称取4.0 g的摩尔盐样品,溶于水,并加入适量稀硫酸。用0.2 mo1/L KMnO4溶液滴定,当溶液中Fe2+全部被氧化时,消耗KMnO4溶液体积 10.00 mL。
①请完成滴定过程中发生的离子方程式:
Fe2++ MnO4-+( )=" " Mn2++ Fe3++ H2O
②本实验的指示剂 ▲ 。
A.酚酞 B.甲基橙 C.石蕊 D.不需要
③KMnO4溶液置于 ▲ (酸式、碱式)滴定管中
④终点颜色的变化: ▲ 。
⑤产品中Fe2+的质量分数为 ▲ 。 (7)在25℃时,相同物质的量浓度的(NH4)2 CO3、(NH4)2SO4、摩尔盐三种盐溶液a,b,c,其铵根离子浓度由小到大的排列顺序为: ▲ 。(用a,b,c回答)
(7)在25℃时,相同物质的量浓度的(NH4)2 CO3、(NH4)2SO4、摩尔盐三种盐溶液a,b,c,其铵根离子浓度由小到大的排列顺序为: ▲ 。(用a,b,c回答)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年安徽省安庆市六校高三第三次联考理综化学试卷(解析版) 题型:填空题
实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),过程如下:
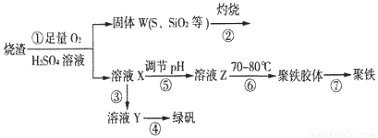
(1)将过程②中的产生的气体通入下列溶液中,溶液会褪色的是__________;
A.品红溶液??????? B.紫色石蕊溶液????? C.酸性KMnO4溶液???? D.溴水
(2)过程①中,FeS和O2、H2SO4反应的化学方程式为:___________________________________。
(3)过程③中,需加入的物质是___________________________。
(4)过程④中,蒸发结晶需要使用酒精灯、三角架、泥三角,还需要的仪器有_______________。
(5)过程⑤调节pH可选用下列试剂中的___________ (填选项序号);
A.稀硫酸??????? B.CaCO3?????? C.NaOH溶液
(6)过程⑥中,将溶液Z加热到70一80℃,目的是_____________________。
(7)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取2.70g样品;②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;③过滤、洗涤、干燥,称量,得固体质量为3.495g。若该聚铁主要成分为[(Fe(OH)(SO4)]n,则该聚铁样品中铁元素的质量分数为___________。(假设杂质中不含铁元素和硫元素)。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年福建省高三上学期期末考试化学试卷(解析版) 题型:填空题
(14分)实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),过程如下:
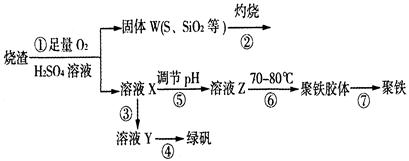
(1)将过程②中的产生的气体通入下列溶液中,溶液会褪色的是 ;
A.品红溶液 B.紫色石蕊溶液 C.酸性KMnO4溶液 D.溴水
(2)过程①中,FeS和O2、H2SO4反应的化学方程式为: ;
(3)过程③中,需加入的物质是 ;
(4)过程④中,蒸发结晶需要使用酒精灯、三角架、泥三角,还需要的仪器有
;
(5)过程⑤调节pH可选用下列试剂中的 (填选项序号);
A.稀硫酸 B.CaCO3 C.NaOH溶液
(6)过程⑥中,将溶液Z加热到70一80℃,目的是 ;
(7)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取2.00g样品;②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;③过滤、洗涤、干燥,称量,得固体质量为2.33g。若该聚铁主要成分为[(Fe(OH)(SO4)]n,则该聚铁样品中铁元素的质量分数为 。(假设杂质中不含铁元素和硫元素)。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江西省高三上学期期中考试化学试卷 题型:填空题
(10分) 以黄铜矿(主要成份为CuFeS2,含少量杂质SiO2等)为原料,进行生物炼铜,同时得到副产品绿矾(FeSO4·7H2O)。其主要流程如下:
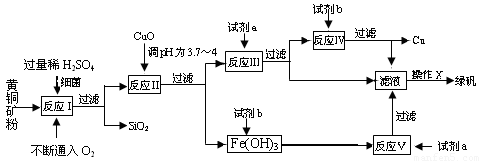
已知:①4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O;
②部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如下表:
|
沉淀物 |
Cu(OH)2 |
Fe(OH)3 |
Fe(OH)2 |
|
开始沉淀pH |
4.7 |
2.7 |
7.6 |
|
完全沉淀pH |
6.7 |
3.7 |
9.6 |
(1)试剂a是___________,试剂b是_____________。
(2)操作X应为蒸发浓缩、________________、________________。
(3)反应Ⅱ中加CuO调pH为3.7~4的目的是
。
(4)反应Ⅴ的离子方程式为___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com