
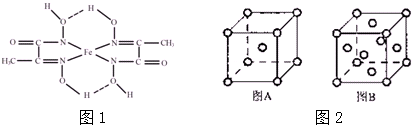
分析 (1)Fe原子的电子排布式是1s22s22p63s23p63d64s2,与铁同周期的所有副族元素的基态原子中,最外层电子数与铁相同的元素的3d轨道电子数为1、2、3、5、10;
(2)A.3p能级有3个轨道,最多容纳6个电子;
B.黑色金属包括铁、铬、锰,d区元素包括ⅢB~ⅦB、Ⅷ族元素;
C.铁的焰色反应焰色反应发出的光不影响其它金属火焰颜色;
D.Fe(CO)5分子含有5个配位键,而CO分子中含有1个σ键;
(3)①非金属性越强,元素的电负性越大;
②根据N原子杂化轨道数目确定杂化发生,而杂化轨道数=σ键+孤对电子数,
③C=N双键的N原子有1对孤对电子与亚铁离子之间形成配位键,另外N原子带1个单位负电荷,与亚铁离子之间形成离子键;
(4)异硫氰酸中 H-N 键极性强,分子间存在氢键,而硫氰酸分子间只存在分子间作用力;
(5)根据均摊法计算晶胞中Fe原子数目,可以计算晶胞质量之比,图A体心立方密堆积,晶胞棱长长度为$\frac{4r}{\sqrt{3}}$cm,图B为面心立方密堆积,晶胞棱长长度为$\frac{\sqrt{2}}{2}$×4r=2$\sqrt{2}$r cm,结合ρ=$\frac{m}{V}$计算.
解答 解:(1)Fe原子的电子排布式是1s22s22p63s23p63d64s2,电子占据最高的能层的符号为N,与铁同周期的所有副族元素的基态原子中,最外层电子数与铁相同的元素的3d轨道电子数为1、2、3、5、10,还有5种,
故答案为:N;5;
(2)A.3p能级有3个轨道,最多容纳6个电子,选项中排列违反了泡利原理,故A正确;
B.黑色金属包括铁、铬、锰,d区元素包括ⅢB~ⅦB、Ⅷ族元素,故B正确;
C.铁的焰色反应焰色反应发出的光不影响其它金属火焰颜色,故C错误
D.Fe(CO)5分子含有5个配位键,而CO分子中含有1个σ键,1molFe(CO)5中含有的σ键数是6NA,故D错误,
故选:AB;
(3)①非金属性越强,元素的电负性越大,则电负性O>N>C>H>Fe,故答案为:O>N>C>H>Fe;
②化合物中形成C=N双键的N原子形成2个σ键,含有1对孤电子对,而形成单键的N原子,形成2个σ键,含有2对孤电子对,杂化轨道数目分别为3、4,N原子采取sp2、sp3杂化,
故答案为:sp2、sp3;
③C=N双键的N原子有1对孤对电子与亚铁离子之间形成配位键,另外N原子带1个单位负电荷,与亚铁离子之间形成离子键,标出亚铁离子的配位键为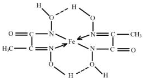 ,
,
故答案为: ;
;
(4)异硫氰酸中 H-N 键极性强,分子间存在氢键,而硫氰酸分子间只存在分子间作用力,所以异硫氰酸的沸点高于硫氰酸,
故答案为:异硫氰酸;
(5)图A体心立方密堆积,晶胞中Fe原子数目为1+8×$\frac{1}{8}$=2,晶胞棱长长度为$\frac{4r}{\sqrt{3}}$cm,图B为面心立方密堆积,晶胞中Fe原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞棱长长度为$\frac{\sqrt{2}}{2}$×4r=2$\sqrt{2}$r cm,晶胞质量之比为2:4=1:2,则A、B两种晶体密度之比是$\frac{1}{(\frac{4r}{\sqrt{3}})^{3}}$:$\frac{2}{(2\sqrt{2r})^{3}}$=$\frac{3\sqrt{6}}{8}$,
故答案为:$\frac{3\sqrt{6}}{8}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、杂化方式、配合物、氢键、晶胞计算等,(3)中配位键判断为易错点,(5)中掌握均摊法进行晶胞计算,关键是理解原子半径与晶胞棱长关系,需要学生具备一定的数学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 锌与稀硫酸反应:Zn+2H+═Zn2++H2↑ | |
| B. | FeCl3溶液中加入氢氧化钠溶液:Fe3++3OH-═Fe(OH)3(胶体) | |
| C. | Ca(NO3)2溶液中滴加少量的Na2CO3溶液:Ca2++CO32-═CaCO3↓ | |
| D. | 常温下氯气与苛性钠溶液反应:Cl2+2OH-═Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 保存FeCl3溶液时,可加入少量NaOH,抑制Fe3+水解 | |
| B. | 1molMg在空气中完全燃烧生成MgO和少量Mg3N2,转移的电子数为2NA | |
| C. | 加入铝粉能产生H2的溶液中可以大量存在Fe2+、Na+、SO42-、ClO-四种离子 | |
| D. | 向硫酸氢铵溶液中滴加少量NaOH溶液时发生反应的离子方程式:H++NH4++20H-═NH3•HzO+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L的氯化铁溶液中:Na+、K+、Br-、SCN- | |
| B. | 水电离出的氢氧根离子浓度为10-13mol/L的溶液中:NH4+、K+、SiO32-、SO42? | |
| C. | 使酚酞试液变红色的溶液中:Na+、K+、HCO3-、S2? | |
| D. | 澄清透明的溶液中:K+、Ca2+、MnO4-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物.
A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
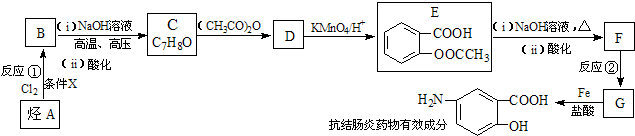
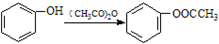
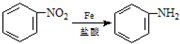
 ;
;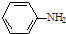 )易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此按先后顺序写出以A为原料合成邻氨基苯甲酸(
)易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此按先后顺序写出以A为原料合成邻氨基苯甲酸( 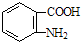 )合成路线中两种中间产物的结构简式(部分反应条件已略去)
)合成路线中两种中间产物的结构简式(部分反应条件已略去)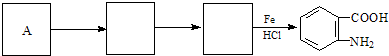
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 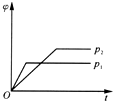 | B. | 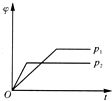 | C. | 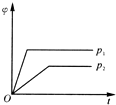 | D. | 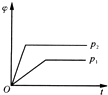 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com